
8.2. Материальный и тепловой баланс процесса нейтрализации в производстве аммофоса
8.2.1. Задание
Составить материальный баланс сатуратора для нейтрализации кислоты в производстве аммофоса (на 1000 кг фосфорной кислоты). Состав экстракционной фосфорной кислоты: 35% Р2О5 ; 2,9% SO3; 0,15% MgO; 1,8% СаО; 1,2% А12О3; 0,3% Fe2O3 ; 1,86% F. Состав жидкого аммиака: 97% NН3; 3% Н2О. В процессе насыщения кислоты аммиаком испаряется 70кг воды на 1000 кг кислоты. Содержание аммиака в нейтрализованной пульпе составляет 27% от общего количества Р2О5. Рассчитать тепловой баланс сатурации в производстве аммофоса на 1000 кг фосфорной кислоты. Температуры: поступающей кислоты 60 °С, аммиака — 27 °С, при давлении 152 кПа (1,5 атм), отходящей пульпы 102 °С.
Материальный баланс
Приход
В приходные статьи баланса включаются экстракционная фосфорная кислота и аммиак.
В 1000 кг кислоты (35% Р2О5) содержится, кг
m(Н3РО4) = m(кислоты) ∙ ω(Р2О5)∙ M(Н3РО4) / M(Р2О5) =
= 1000 ∙ 0,35 ∙2 ∙ 98 / 142 = 483,1кг
m(Н2О) = m(кислоты) - m(Н3РО4) = 1000 – 483,1 = 516,9 кг,
где M(Н3РО4) и M(Р2О5) — молекулярные массы Н3РО4 и Р2О5.
Количество расходуемого аммиака равно 27% от общего количества Р205, т. е.
mо(NН3) = m(кислоты) ∙ ω(Р2О5) ∙ ω1(NН3) =
= 1000∙0,35∙0,27=94,5 кг
С аммиаком поступает воды:
m1 = m0(NН3) ∙ ω(Н2О) / ω(NН3) = (67,5∙ 3) / 97 = 2,9кг,
где ω(Н2О), ω(NН3) - состав жидкого аммиака: 97% NН3, 3% Н2О
Расход
В результате обработки фосфорной кислоты аммиаком образуется пульпа и испаряется некоторое количество воды. Состав образующейся массы определяется взаимодействием кислоты с содержащимися в ней примесями и аммиаком. В основу расчета количеств получаемых солей берем следующие стехиометрические соотношения
MgO + Н3РО4 + 2Н2О = MgHРО4∙3Н2О (1)
CaO + Н3РО4 + Н2О = CaHРО4∙2Н2О (2)
Al2O3 + 2Н3РО4 = 2AlРО4 + 3Н2О (3)
Fe2O3 + 2Н3РО4 = 2FeРО4 + 3Н2О (4)
2NН3 + H2SiF6 = (NH4)2SiF6 (5)
2NН3 + H2SO4 = (NH4)2SO4 (6)
NН3 + Н3РО4 = NH4H2PO4 (7)
2NН3 + Н3РО4 = (NH4) 2HPO4 (8)
При нейтрализации раствора фосфорной кислоты аммиаком в отделении сатурации получаются следующие соли, кг
- гидрофосфат магния:
m(MgHРО4∙3Н2О)=m(кислоты)∙ω(MgO)∙M(MgHРО4∙3Н2О)/M(MgO) =1000∙ 0,0015∙174 / 40 = 6,5 кг,
в том числе кристаллизационной воды
m1(Н2О) =m(кислоты)∙ω(MgO)∙3∙M(Н2О)/M(MgO) = 1000∙ 0,0015∙ 3∙ 18/40 = 2,0 кг,
в том числе Р2О5
m1(Р2О5) = m(кислоты)∙ ω(MgO)∙M(Р2О5) / 2M(MgO) = 1000∙ 0,0015∙142/(40∙2) = 2,7 кг;
- гидрофосфат кальция
m(СаНРО4∙2Н2О) = m(кислоты) ∙ ω(СаО) ∙ M(СаНРО4∙2Н2О)/M(СаО) =
= 1000 ∙ 0,018 ∙ 172 / 56 = 55,3 кг ;
в том числе кристаллизационной воды
m2(Н2О) = m(кислоты) ∙ ω(СаО)∙2 M(Н2О) / M(СаО) =
= 1000 ∙0,018 ∙ 2 ∙ 18 / 56 = 11,6 кг
в том числе Р2О5
m2(Р2О5) = m(кислоты) ∙ ω(СаО)∙ M(Р2О5) / 2M(СаО) =
= 1000∙ 0,018∙ 142/(56∙2) = 22,8 кг ;
- фосфат алюминия
m(AlPO4)=m(кислоты)∙ω(Аl2О3)∙2M(AlPO4)/M(Аl2О3) =
=1000∙0,012∙2∙122/102 = 28,7 кг ,
в том числе Р2О5
m3(Р2О5) = m(кислоты)∙ ω(Аl2О3)∙ M(Р2О5) / M(Аl2О3) =
= 1000∙0,012∙142 / 102 = 16,7 кг;
- фосфат железа
m(FePO4) = m(кислоты) ∙ ω(Fe2O3)∙ 2M(FePO4) / M(Fe2O3)=
= 1000 ∙ 0,003∙ 2 ∙ 151 / 160 = 5,7 кг,
в том числе Р2О5
m4(Р2О5) = m(кислоты)∙ ω(Fe2O3)∙ M(Р2О5) / M(Fe2O3) =
= 1000 ∙ 0,003∙ 142 / 160 = 2,9 кг;
- кремнефторид аммония
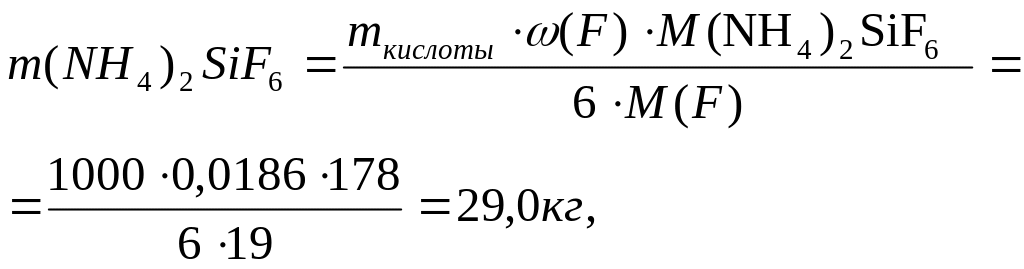
в том числе NН3
![]()
- сульфат аммония
m((NH4)2SO4) = m(кислоты) ∙ ω(SO3)∙ M((NH4)2SO4) / M(SO3) =
= 1000∙ 0,029∙ 132 / 80 = 47,9 кг,
в том числе NH3∙ ω(SO3) ∙ 2M(NH3) / M(SO3) =
= 1000 ∙ 0,029∙ 2 ∙ 17 / 80 = 12,3 кг.
Количество Р2О5, связанной по реакциям (1) – (4):
mr(Р2О5) = m1(Р2О5) + m2(Р2О5) + m3(Р2О5) + m4(Р2О5) =
= 2,7 + 22,8 + 16,7 + 2,7 = 44,9 кг.
Остальное количество Р2О5 связывается с аммиаком, образуя фосфаты аммония. Количество Р2О5, нейтрализуемое аммиаком
mн(Р2О5) = m(фосфорной кислоты)∙ ω(Р2О5) - mr(Р2О5) = 1000∙ 0,35 - 44,9= 305,1кг.
Содержание аммиака в нейтрализованной пульпе составляет 27% от общего количества Р2О5. Израсходовано аммиака на образование кремнефторида и сульфата аммония
5,5 + 12,3 = 15,8 кг .
Следовательно, на образование фосфатов аммония пошло аммиака:
mф(NH3) = m(фосфорной кислоты)∙ ω(Р2О5) ∙ ω(NH3) - m(NH3) =
= 1000∙ 0,35 ∙ 0,27 – 15,8 = 78,7 кг
Количество аммиака, необходимое для связывания оставшейся Р2О5 (305,1кг) в моноаммонийфосфат
mост(NH3) = 2 ∙ М(NH3) ∙ mн(Р2О5) / M(Р2О5) = 2 ∙ 17∙ 305,1 / 142 = 73,1 кг
При этом остается избыточного аммиака
mизб(NH3) = mф(NH3) – mост(NH3) = 78,7 – 73,1 = 5,6 кг,
который идет на образование диаммонийфосфата; его количество
m((NН4)2НРО4) = mизб(NH3) ∙ M((NН4)2НРО4) / (2∙ M(NH3)) = 5,6 ∙ 132 / (2 ∙17) = 21,7 кг
Это количество требует моноаммонийфосфата
m(NH4H2PO4) = m((NН4)2НРО4)∙ M(NH4H2PO4) / M((NН4)2НРО4)=
= 21,7 ∙ 115 / 132 = 18,9 кг
Так как из 305,1 кг Р2О5 могло образоваться моноаммонийфосфата
mв(NH4H2PO4) = M(NH4H2PO4) ∙ mост(NH3) / M(NH3) =
= 115 ∙ 73,1 / 17 = 494,5 кг,
то после образования диаммонийфосфата останется моноаммонийфосфата
mост(NH4H2PO4) = mв(NH4H2PO4) - m(NH4H2PO4) =
= 494,5 – 18,9 = 475,6 кг
Выход сухих солей (с учетом кристаллизационной воды) составляет :
m(соли) = m(MgHРО4∙3Н2О) + m(СаНРО4•2Н2О) + m(AlPO4) + m(FePO4) + m((NH4)2SO4) + mост(NH4H2PO4) + m((NН4)2НРО4) + m(NH4)2SiF6 = 6,5 + 55,3 + 28,7 + 5,7+ 47,9 + +475,6 + 21,7 + 29 = 670,4 кг,
в том числе воды кристаллизационной
m(Н2О) = m1(Н2О) + m2(Н2О) = 2,0 + 11,6 = 13,6 кг.
Выход сухих солей без кристаллизационной воды:
m(соли без воды) = m(соли) - m(Н2О) = 670,4 — 13,6 = 656,8 кг.
Cостав сухих солей представим в виде таблицы (табл. 1)
Таблица 1
Cостав сухих солей с учетом кристаллизационной воды
Соли |
Масса, кг |
Содержание, % |
MgHPО4•3H2O |
6,5 |
1,0 |
СаНРО4•2Н2О |
55,3 |
8,2 |
А1РО4 |
28,7 |
4,3 |
FePO4 |
5,7 |
0,8 |
(NH4)2SiF6 |
29.0 |
4.3 |
(NH4)2SО4 |
47,9 |
7,1 |
(NH4)2НРО4 |
21.7 |
3.2 |
NH4H2РО4 |
475.6 |
68,2 |
Всего |
670,4 |
100 |
В систему поступает материалов (фосфорной кислоты, аммиака и воды с ним)
m(материала) = m(фосфорной кислоты) + m(NН3) + m1 = 1000 + 94,5 + 2,9 =
= 1097,4 кг.
В процессе сатурации из системы испаряется 70 кг воды на 1000 кг кислоты. Количество пульпы после испарения воды равно
m(пульпы) = m(материала) – m(вода в пульпе) = 1097,4 - 70 = 1027,4 кг.
В конечной пульпе содержится свободной воды:
m(свободной воды) = m(пульпы) - m(соли) = 1027,4 - 672,5 = 3547,0 кг.
Всего воды в пульпе:
mк(воды) = m(свободной воды) + m(Н2О) = 357 + 13,6 = 370,6 кг.
Процентное содержание общей влаги в пульпе:
ω(вода в пульпе) = mк(воды) ∙ 100 / m(пульпы) =
= (370,6 ∙ 100) / 1027,4 = 36,1%.
Составляем материальный баланс сатурации в производстве аммофоса (на 1000 кг фосфорной кислоты) (табл. 2):
Таблица 2
Материальный баланс сатурации в производстве аммофоса
Приход |
кг |
% |
Расход |
кг |
% |
35%-ная по Р2О5 экст-ракционная кислота в пересчете на моногиграт (100%Н3РО4) |
483.1 |
44.02 |
Солевая масса пульпы в том числе: MgHPО4•3H2O СаНРО4•2Н2О А1РО4 FePO4 (NH4)2SiF6 (NH4)2SО4 (NH4)2НРО4 NH4H2РО4 |
670,4
6,5 55.3 28.7 5,7 29.0 47.9 21.7 475.6 |
61.4 |
Вода с фосфорной кислотой |
516.9 |
47.10 |
|||
аммиак |
94.5 |
8.61 |
Вода в пульпе (свободная) |
357,0 |
32.2 |
Вода с аммиаком |
2.9 |
0.27 |
Водяной пар |
70.0 |
6.4 |
Итого |
1097.4 |
100 |
Итого |
1097.4 |
100 |
