
- •Буферные системы организма.
- •Буферная мощность белковой системы составляет 5% от общей буферной емкости крови.
- •Регуляция кос физиологическими системами организма.
- •Показатели кос в плазме крови.
- •Типы нарушений кос
- •Причины метаболического ацидоза :
- •Кетоновый ацидоз
- •Причины дыхательного ацидоза :
- •Причины метаболического алкалоза:
Лекция № 42: ИССЛЕДОВАНИЕ ПОКАЗАТЕЛЕЙ КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ КРОВИ.
В ходе метаболизма в организме человека постоянно происходит образование кислых и щелочных продуктов. Кислотой является вещество, способное отдавать ион водорода Н+ (донатор иона водорода) , а основанием - вещество, способное присоединять Н+ (акцептор иона водорода). Кислотность или щелочность раствора зависит от концентрации в нем свободных протонов Н+.
Постоянство концентрации водородных ионов является одним из свойств крови, которое необходимо для нормального существования организма. За пределами допустимого диапазона происходит денатурация белков: разрушаются клетки, ферменты теряют способность выполнять свои функции, возможна гибель организма. Поэтому КОС в организме жёстко регулируется.
В поддержании КОС принимают участие:
буферные системы крови;
легкие, удаляющие углекислый газ;
почки, реабсорбирующие бикарбонат и выделяющие ион водорода.
Буферные системы организма.
Буферными системами называют системы, способные поддерживать постоянство концентрации водородных ионов при добавлении некоторого количества кислоты или основания.
Существует несколько буферных систем крови – бикарбонатная, белковая, гемоглобиновая, фосфатная.
Бикарбонатная буферная система. Эта система состоит из бикарбонат-иона (НСО3–) и угольной кислоты (Н2СО3), буферная мощность составляет 65% от общей буферной емкости крови. Работа этой системы неразрывно и тесно связана с легкими.
При поступлении в кровь протонов Н+, ионы бикарбоната взаимодействуют с ней, и образуется угольная кислота. Угольная кислота - нестойкое соединение, разлагается с образованием воды и двуокиси углерода, последний через дыхательную систему удаляется в атмосферу. Учитывая эту особенность, бикарбонатную буферную систему называют летучим буфером.
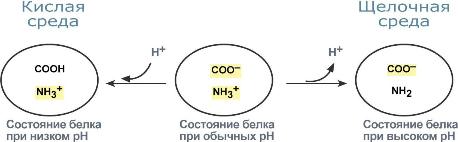
Буферная мощность белковой системы составляет 5% от общей буферной емкости крови.
Белки плазмы играют роль буфера благодаря своим амфотерным свойствам. В кислой среде подавляется диссоциация СООН-групп, а группы NH2 связывают избыток Н+, при этом белок заряжается положительно. В щелочной среде усиливается диссоциация карбоксильных групп, образующиеся Н+ связывают избыток ОН–-ионов и pH сохраняется, белки выступают как кислоты и заряжаются отрицательно.
На долю гемоглобинового буфера приходится до 30% всей буферной емкости крови.
Данный буфер представлен несколькими подсистемами:
Гемоглобиновые подсистемы
![]()
![]()
![]()
![]()
Пара ННb/ННbО2 является основной в работе гемоглобинового буфера. Соединение ННbО2 является более сильной кислотой по сравнению с угольной кислотой, HHb - более слабая кислота, чем угольная. Установлено, что ННbО2 в 80 раз легче отдает ионы водорода, чем ННb.
Работа гемоглобинового буфера неразрывно связана с дыхательной системой.
В легких после удаления СО2 (угольной кислоты) происходит защелачивание крови. При этом присоединение О2 к дезоксигемоглобину H-Hb образует кислоту ННbО2 более сильную, чем угольная. Она отдает свои ионы Н+ в среду, предотвращая повышение рН:
Н-Hb + O2 → [H-HbO2] → НbO2 + Н+
В капиллярах тканей постоянное поступление кислот (в том числе и угольной) из клеток приводит к диссоциации оксигемоглобина НbO2 и связыванию ионов Н+ в виде Н-Hb:
НbO2+ Н+ → [H-HbO2] → Н-Hb + O2
Фосфатная буферная система составляет около 1-2% от всей буферной емкости крови. Она образована дигидрофосфатом (H2PO4-) и гидрофосфатом (HPO42-). Первое соединение ведет себя как слабая кислота, второе обладает щелочными свойствами.
При взаимодействии ионов водорода с гидрофосфатом (HPO42-), образуется соль дигидрофосфата (H2PO4–).
Регуляция кос физиологическими системами организма.
Дыхательная система. - Легочная вентиляция обеспечивает удаление угольной кислоты, образованной при функционировании бикарбонатной буферной системы. По скорости реакции на изменение рН – это вторая система после буферных систем.
Фактором для активации дыхательной системы является концентрация ионов Н+. Накопление ионов Н+ в крови уже через 1-2 минуты вызывает стимуляцию дыхательного центра, повышая его активность до 4-5 раз, при этом молекулы СО2 выводятся в большем количестве и рН возвращается к нормальному уровню. И, наоборот, снижение кислотности крови понижает активность дыхательного центра на 50-75%, в результате напряжение СО2 и концентрация ионов Н+ возрастает; сдвиг реакции крови в щелочную сторону частично компенсируется.
Оценку альвеолярной вентиляции проводят путем измерения рСО2.
Почки. - В организме ежедневно часть кислых продуктов образуется в виде нелетучих кислот, которые экскретируются почками. Развитие почечной реакции на смещение кислотно-основного состояния происходит в течение нескольких часов и даже дней.
Функция почек, направленная на поддержание КОС, состоит из поставки в кровоток дополнительных количеств ионов НСО3- и выведения Н+ с мочой. Эта функция реализуется за счет трех процессов:
Реабсорбция бикарбонатных ионов HCO3–.
Ацидогенез – удаление ионов Н+ с выводимыми кислотами (в основном в составе дигидрофосфатов NaH2PO4).
Аммониегенез – удаление ионов Н+ в составе ионов аммония NH4+.
Летучие кислоты экскретируются из организма только через легкие.
Нелетучие кислоты экскретируются только почками.
