
- •Содержание
- •Введение § 1. Предмет и задачи токсикологической химии, ее связь с другими дисциплинами
- •§ 2. Краткий исторический очерк возникновения и развития отечественной токсикологической химии
- •Глава I. Общие вопросы химико-токсикологического анализа
- •§ 1. Объекты химико-токсикологического анализа. Вещественные доказательсва
- •§ 2. Особенности химико-токсикологического анализа
- •§ 3. Осмотр объектов исследования и определение некоторых их свойств
- •§ 4. Предварительные пробы в химико-токсикологическом анализе
- •§ 5. План химико-токсикологического анализа
- •§ 6. Организация органов судебно-медицинской и судебно-химической экспертизы в ссср
- •§ 7. Эксперт-химик
- •§ 8. Правила судебно-химической экспертизы вещественных доказательств
- •§ 9. Акт судебно-химической экспертизы вещественных доказательств
- •§ 10. Некоторые вопросы терминологии в токсикологической химии
- •§ 11. Классификация ядовитых и сильнодействующих веществ в токсикологической химии
- •Глава II. Отравления и некоторые вопросы токсикокинетики ядов
- •§ 1. Отравления и их классификация
- •§ 2. Пути поступления ядов в организм
- •§ 3. Всасывание ядов в организме
- •§ 4. Распределение ядов в организме
- •§ 5. Связывание ядов в организме
- •§ 6. Выделение ядов из организма
- •§ 7. Факторы, влияющие на токсичность химических соединений
- •§ 8. Методы детоксикации
- •§ 9. Метаболизм чужеродных соединений
- •§ 10. Окисление чужеродных соединений
- •§ 11. Восстановление чужеродных соединений
- •§ 12. Гидролиз чужеродных соединений
- •§ 13. Дезалкилирование, дезаминирование и десульфирование чужеродных соединений
- •§ 14. Другие метаболические превращения
- •§ 15. Реакции конъюгации
- •§ 16. Посмертные изменения лекарственных веществ и ядов в трупах
- •§ 17. Разложение биологического материала после наступления смерти
- •§ 18. Изменение ядов при разложении трупов
- •Глава III. Методы анализа, применяемые в токсикологической химии
- •§ 1. Метод экстракции
- •§ 2. Микрокристаллоскопический анализ
- •§ 3. Метод микродиффузии
- •Глава IV. Ядовитые и сильнодействующие вещества, изолируемые из биологического материала перегонкой с водяным паром
- •§ 1. Аппараты для перегонки с водяным паром
- •§2. Влияние рН среды на перегонку химических соединений с водяным паром
- •§ 3. Перегонка ядовитых веществ с водяным паром из подкисленного биологического материала
- •§ 4. Перегонка ядовитых веществ с водяным паром из подкисленного, а затем из подщелоченного биологического материала
- •§ 5. Фракционная перегонка веществ, содержащихся в дистиллятах
- •§ 6. Синильная кислота
- •§ 7. Формальдегид
- •§ 8. Метиловый спирт
- •§ 9. Этиловый спирт
- •§ 10. Изоамиловый спирт
- •§ 11. Ацетон
- •§ 12. Фенол
- •§ 13. Крезолы
- •§ 14. Хлороформ
- •§ 15. Хлоралгидрат
- •§ 16. Четыреххлористый углерод
- •§ 17. Дихлорэтан
- •§ 18. Реакции, позволяющие отличить хлорпроизводные друг от друга
- •§ 19. Тетраэтилсвинец
- •§ 20. Уксусная кислота
- •§ 21. Этиленгликоль
- •Глава V. Ядовитые и сильнодействующие вещества, изолируемые из биологического материала подкисленным этиловым спиртом или подкисленной водой
- •§ 1. Развитие методов выделения алкалоидов и других азотистых оснований из биологического материала
- •§ 2. Влияние рН среды на изолирование алкалоидов и других азотистых оснований из биологического материала
- •§ 3. Влияние состава извлекающих жидкостей на изолирование алкалоидов и других азотистых основании из биологического материала
- •§ 4. Влияние подкисленной воды и подкисленного спирта на извлечение примесей, переходящих в вытяжки из биологического материала
- •§ 5. Очистка вытяжек из биологического материала от примесей
- •§ 6. Экстракция алкалоидов и других токсических веществ из вытяжек
- •§ 7. Обнаружение ядовитых веществ, изолируемых подкисленной водой или подкисленным этиловым спиртом
- •§ 8. Количественное определение токсических веществ, изолированных подкисленной водой или подкисленным спиртом
- •§ 9. Метод выделения токсических веществ, основанный на изолировании их этиловым спиртом подкисленным щавелевой кислотой
- •§ 10. Метод выделения токсических веществ, основанный на изолировании их водой, подкисленной щавелевой кислотой
- •§ 11. Метод выделения токсических веществ, основанный на изолировании их водой, подкисленной серной кислотой
- •§ 12. Барбитураты и методы их исследования
- •§ 13. Барбамил
- •§ 14. Барбитал
- •§ 15. Фенобарбитал
- •§ 16. Бутобарбитал
- •§ 17. Этаминал-натрий
- •8. Обнаружение этаминала-натрия по уф- и ик-спектрам.
- •§ 18. Бензонал
- •§ 19. Гексенал
- •§ 20. Производные ксантина
- •§ 21. Кофеин
- •§ 22. Теобромин
- •§ 23. Теофиллин
- •§ 24. Наркотин
- •§ 25. Меконовая кислота
- •§ 26. Меконин
- •§ 27. Ноксирон
- •§ 28. Салициловая кислота
- •§ 29. Антипирин
- •§ 30. Амидопирин
- •§ 31. Фенацетин
- •§ 32. Хинин
- •§ 33. Опий и омнопон
- •§ 34. Морфин
- •§ 35. Кодеин
- •§ 36. Папаверин
- •§ 37. Галантамин
- •§ 38. Анабазин
- •§ 39. Никотин
- •§ 40. Ареколин
- •§ 41. Кониин
- •§ 42. Атропин
- •§ 43. Скополамин
- •§ 44. Кокаин
- •§ 45. Стрихнин
- •§ 46. Бруцин
- •§ 47. Резерпин
- •§ 48. Пахикарпин
- •§ 49. Секуренин
- •§ 50. Эфедрин
- •§ 51. Аконитин
- •§ 52. Новокаин
- •§ 53. Дикаин
- •§ 54. Аминазин
- •§ 55. Дипразин
- •§ 56. Тизерцин
- •§ 57. Хлордиазепоксид
- •§ 58. Диазепам
- •§ 59. Нитразепам
- •§ 60. Оксазепам
- •§ 61. Апоморфин
- •§ 62. Дионин
- •§ 63. Промедол
- •Глава VI. Вещества, изолируемые из объектов минерализацией биологического материала
- •§ 1. Связывание «металлических ядов» биологическим материалом
- •§ 2. Методы минерализации органических веществ
- •§ 3. Сухое озоление и сплавление органических веществ
- •§ 4. Окислители, применяемые для минерализации органических веществ
- •§ 5. Отбор и подготовка проб биологического материала для минерализации
- •§ 6. Разрушение биологического материала азотной и серной кислотами
- •§ 7. Разрушение биологического материала хлорной, азотной и серной кислотами
- •§ 8. Разрушение биологического материала пергидролем и серной кислотой
- •§ 9. Дробный метод и систематический ход анализа «металлических ядов»
- •§ 10. Маскировка ионов в дробном анализе
- •§ 11. Реактивы, применяемые в дробном анализе «металлических ядов» для маскировки ионов
- •§ 12. Реакции, применяемые в химико-токсикологическом анализе для обнаружения ионов металлов
- •§ 13. Соединения бария
- •§ 14. Соединения свинца
- •§ 15. Соединения висмута
- •§ 16. Соединения кадмия
- •§ 17. Соединения марганца
- •§ 18. Соединения меди
- •§ 19. Соединения мышьяка
- •§ 20. Соединения серебра
- •§ 21. Соединения сурьмы
- •§ 22. Соединения таллия
- •§ 23. Соединения хрома
- •§ 24, Соединения цинка
- •§ 25. Соединения ртути
- •§ 26. Количественное определение «металлических ядов» в минерализатах
- •§ 27. Количественное определение ртути
- •§ 28. Экстракционно-фотоколориметрическое определение меди
- •Глава VII. Вещества, изолируемые из биологического материала настаиванием исследуемых объектов с водой
- •Минеральные кислоты и щелочи
- •§ 1. Серная кислота
- •§ 2. Азотная кислота
- •§ 3. Соляная кислота
- •§ 4. Гидроксид калия
- •§ 5. Гидроксид натрия
- •§ 6. Аммиак
- •§ 7. Нитриты
- •Глава VIII. Ядохимикаты и методы их химико-токсикологического анализа
- •§ 1. Классификация ядохимикатов
- •§ 2. Гексахлорциклогексан (гхцг)
- •§ 3. Гептахлор
- •§ 4. Фосфорсодержащие органические соединения и методы их анализа
- •§ 5. Хлорофос
- •§ 6. Карбофос
- •§ 7. Метафос
- •§ 8. Карбарил
- •§ 9. Гранозан
- •Глава IX. Вещества, определяемые непосредственно в биологическом материале
- •§ 1. Оксид углерода (II)
- •§ 2. Спектроскопический метод обнаружения оксида углерода (II) в крови
- •§ 3. Химические методы обнаружения оксида углерода (II) в крови
- •§ 4. Количественное определение оксида углерода (II) в крови
- •Приложение 1. Приготовление реактивов
- •Приложение 2. Приготовление хроматографических пластинок
- •Список рекомендуемой литературы
§ 38. Анабазин
Анабазин — алкалоид, содержащийся в ежевнике безлистном. Небольшие количества анабазина содержатся в табаке. Основание анабазина представляет собой бесцветную маслянистую жидкость, которая хорошо растворяется в воде и ряде органических растворителей.

Анабазин экстрагируется органическими растворителями как из кислых, так и из щелочных водных растворов. Однако большие количества анабазина экстрагируются из щелочных водных растворов, из которых он перегоняется с водяным паром без разложения.
Применение. Действие на организм. Анабазина гидрохлорид применяется в виде таблеток для облегчения отвыкания от курения. Сумма сульфатов алкалоидов, выделенных из ежевника безлистного, в смеси с хозяйственным мылом применяется в сельском хозяйстве для борьбы с вредителями растений. Для указанной цели также применяется анабадуст. Анабазин применяется в ветеринарии для борьбы с вшивостью животных, для лечения стригущего лишая и чесотки у животных и т. д.
В малых дозах анабазин возбуждает центральную нервную систему, усиливает дыхание, повышает кровяное давление, возбуждает ганглии вегетативной нервной системы. В больших дозах анабазин оказывает угнетающее и парализующее действие вегетативных ганглиев. Анабазин проникает в организм с вдыхаемым воздухом, а также через неповрежденную кожу и может давать тяжелые отравления. Выделяется из организма с мочой. Метаболизм анабазина изучен недостаточно.
Выделение анабазина из биологического материала. Для выделения анабазина применяют метод, основанный на изолировании алкалоидов водой, подкисленной серной кислотой, а также метод перегонки с водяным паром.
Один из методов выделения анабазина основан на том, что биологический материал настаивают с водой, подкисленной серной кислотой. Полученную кислую вытяжку фильтруют или центрифугируют, подщелачивают и взбалтывают с хлороформом или другими органическими растворителями, в которые переходит основание анабазина.
Учитывая летучесть основания анабазина, хлороформную вытяжку насыщают газообразным хлороводородом. В результате этого основание анабазина переходит в нелетучий гидрохлорид этого алкалоида. После этого хлороформную вытяжку выпаривают досуха. В сухом остатке определяют наличие анабазина. Подробно методика выделения анабазина из биологического материала приводится ниже.
Для насыщения хлороформной вытяжки газообразным хлороводородом берут колбу Вюрца вместимостью 50—100 мл, в которую вносят 25 мл раствора соляной кислоты (плотность 1,19). Колбу Вюрца закрывают пробкой с капельной воронкой, в которую вносят концентрированную серную кислоту (плотность 1,84). Затем из капельной воронки к соляной кислоте по каплям прибавляют концентрированную серную кислоту. При этом выделяется газообразный хлороводород, который в течение 2—3 мин пропускают через хлороформную вытяжку из биологического материала, содержащую анабазин.
Получение хлороводорода и насыщение им хлороформной вытяжки проводят под тягой.
В стакан вместимостью 500 мл вносят 100 г измельченного биологического материала (печень, почки, желудок с содержимым и др.) и приливают такое же количество 0,02 н. раствора серной кислоты, чтобы жидкость полностью покрыла твердые частицы исследуемого объекта. Смесь хорошо перемешивают и проверяют рН по универсальному индикатору (рН смеси должен составлять ~ 2,5). При необходимости прибавляют 10 %-й раствор серной кислоты до рН = 2,5. Смесь оставляют на 2 ч при периодическом перемешивании, затем сливают водную вытяжку и процеживают ее через марлю, а биологический материал еще 2 раза настаивают с новыми порциями 0,02 н. раствора серной кислоты, как указано выше.
Водные вытяжки соединяют, переносят в стакан (пробирку) для центрифугирования и центрифугируют. Центрифугат сливают, оставшийся в стакане (пробирке) твердый остаток перемешивают стеклянной палочкой, прибавляют к нему 5—10 мл 0,02 н. раствора серной кислоты и снова центрифугируют. Центрифугат сливают и присоединяют его к ранее полученному центрифугату.
К объединенному центрифугату прибавляют порошкообразный сульфат аммония до насыщения (при этом рН жидкости должно сохраняться~2,5). Смесь центрифугата и сульфата аммония оставляют на 2 ч, после чего осадок отделяют центрифугированием. Центрифугат переносят в делительную воронку и 2 раза в течение 5—10 мин взбалтывают с диэтиловым эфиром (порциями по 50 мл). Эфирные вытяжки отделяют и в дальнейшем не исследуют.
Оставшийся в делительной воронке кислый раствор подщелачивают 5 %-м раствором гидроксида натрия до рН = 8,5...9,0 и 3 раза взбалтывают с хлороформом (порциями по 50 мл). Хлороформные вытяжки соединяют, фильтруют через бумажный фильтр, а затем фильтрат насыщают газообразным хлороводородом в течение 2—3 мин и отгоняют хлороформ досуха. Сухой остаток или его раствор в хлороформе используют для идентификации и количественного определения анабазина.
Обнаружение анабазина
Реакция с реактивом Драгендорфа. На предметное стекло наносят 2—3 капли хлороформного раствора исследуемого вещества и выпаривают досуха. К сухому остатку прибавляют каплю 0,1 н. раствора соляной кислоты и каплю реактива Драгендорфа. Предметное стекло вносят во влажную камеру (см. гл. 3, § 2) на 20—30 мин, а затем продукт реакции рассматривают под микроскопом. Появление сростков, состоящих из оранжево-красных кристаллов, имеющих игольчатую форму, указывает на наличие анабазина в исследуемом растворе. Предел обнаружения: 1 мкг анабазина в пробе.
С реактивом Драгендорфа кристаллические осадки дают ко-ниин, никотин и ряд других азотсодержащих веществ. Однако форма кристаллов анабазина с реактивом Драгендорфа отличается от формы кристаллов других указанных веществ.
Реакция с солью Рейнеке. На предметное стекло наносят 2— 3 капли раствора исследуемого вещества и выпаривают досуха. К сухому остатку прибавляют каплю 0,01 н. раствора соляной кислоты и каплю 1 %-го свежеприготовленного раствора соли Рейнеке. При наличии анабазина в пробе через несколько минут под микроскопом наблюдаются сростки, состоящие из мелких игольчатых кристаллов, которые несколько увеличиваются при стоянии. Предел обнаружения: 0,7 мкг анабазина в пробе.
Реакцию с солью Рейнеке дает и никотин, но форма кристаллов рейнеката никотина отличается от формы кристаллов рейнеката анабазина.
Реакция с пикриновой кислотой. К капле исследуемого раствора прибавляют 2 капли насыщенного раствора пикриновой кислоты. При наличии анабазина в растворе выпадает желтый кристаллический осадок. Никотин не дает этой реакции.
Реакция с реактивом Бушарда. К 2—3 каплям исследуемого раствора прибавляют каплю реактива Бушарда. При наличии анабазина выпадает красно-бурый осадок. Эту реакцию дает и никотин.
Реакция с пергидролем. В пробирку вносят 1 мл исследуемого раствора, 1 мл пергидроля и 2—3 капли концентрированной серной кислоты. Появление красной или шоколадно-коричневой окраски указывает на присутствие анабазина в растворе. Эту реакцию дает и никотин.
Реакция с ванилином. К 1 мл исследуемого раствора прибавляют кристаллик ванилина и 1—2 капли концентрированной соляной кислоты. Появление красной или вишнево-красной окраски указывает на наличие анабазина в пробе. Эту реакцию дает и никотин.
Фотоколориметрическое определение анабазина
Описанный ниже метод фотоколориметрического определения анабазина базируется на реакции Кенига, который установил, что при взаимодействии пиридина и его производных, имеющих свободные α- и α'-положения, с хлорцианом или бромцианом образуется хлорид или бромид цианпиридиния:

При взаимодействии цианпиридиния с водой образуется глутаконовый альдегид, который может быть в двух таутомерных формах:

Необходимый для реакции Кенига хлорциан может быть получен при взаимодействии хлорамина с цианидами:

Учитывая высокую токсичность хлорциана, в последнее время ряд исследователей рекомендуют заменить его бромроданом (BrSCN).
С. И. Банк и другие исследователи использовали описанную выше реакцию Кенига для фотоколориметрического определения анабазина, никотина и других производных пиридина. С этой целью к раствору анабазина прибавляют цианид калия и хлорамин Б. При этом образуется производное глутаконового альдегида:
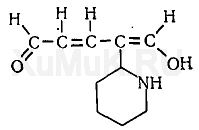
При взаимодействии производного глутаконового альдегида с барбитуровой кислотой образуется краситель, имеющий желто-оранжевую окраску:

Выполнение определения: 20 мл указанной выше хлороформной вытяжки, насыщенной газообразным хлороводородом, выпаривают досуха. Сухой остаток растворяют в 5 мл воды, 1 мл этого раствора вносят в мерную колбу вместимостью 50 мл, прибавляют 2 мл 1 %-го водного раствора цианида калия (осторожно — яд!) и 5 мл 1 %-го водного раствора хлорамина Б. Жидкость хорошо взбалтывают и через 5 мин прибавляют 10 мл 0,5 %-го водного раствора барбитуровой кислоты, а затем объем жидкости в колбе доводят водой до метки. Жидкость хорошо перемешивают и через 50 мин измеряют оптическую плотность окрашенного в желто-оранжевый цвет раствора с помощью фотоэлектроколориметра ФЭК-М (светофильтр зеленый, кювета 10 мм). В качестве раствора сравнения применяют смесь, состоящую из 2 мл раствора цианида калия, 5 мл раствора хлорамина Б, 10 мл раствора барбитуровой кислоты и 33 мл воды.
Содержание анабазина в пробе рассчитывают по калибровочному графику. Для построения этого графика в 6 мерных колб вместимостью 50 мл каждая вносят по 0,1; 0,2; 0,4; 0,6; 0,8 и 1,0 мл стандартного раствора анабазина (в 1 мл содержится 1 мг этого препарата). В первые 5 мерных колб прибавляют воду до 1 мл, затем во все колбы прибавляют по 2 мл 1 %-го раствора цианида калия и по 5 мл 1 %-го раствора хлорамина Б, а далее поступают, как указано выше.
