
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
- •1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
1. Закончить и написать в молекулярной ,полной и сокращенной ионно-молекулярной формах
а) хлорид цинка + нитрат серебра→...
б) сульфат алюминия (III) + вода ↔ ...
в) нитрат свинца + карбонат натрия + вода →...
г) иодид алюминия + метасиликат натрия→...
закончить составление схемы уравнения и расставить коэффициенты используя метод ионно-электронного баланса:
а) хлорид железа (II) + перманганат калия + соляная кислота → хлорид железа(III)...
б) нитрит натрия + хлор + гидроксид натрия → ...
a) ZnCl2+2AgNO3=2AgCl↓+Zn(NO3)2 молекулярное уравнение
Zn2++2Cl-+2Ag++2NO3-=2AgCl↓+Zn2++2NO3- полное ионно-молекулярное уравнение
Cl-+Ag+=AgCl↓ сокращенное ионно-молекулярное уравнение
б) Al2(SO4)3+2H2O↔2Al(OH)SO4+ H2SO4 молекулярное уравнение
2Al3++2SO42- +2H2O↔2Al(OH)2++2 SO42-+2 H++ SO42- полное ионно-молекулярное уравнение
Al3+ +H2O↔Al(OH)2++ H+ сокращенное ионно-молекулярное уравнение
в) Pb(NO3)2+Na2CO3+ H2O=Pb(OH)2↓+2NaNO3+ CO2↑ молекулярное уравнение
Pb2++ 2NO3-+2Na++ CO32- + H2O= Pb(OH)2↓+2Na++ 2NO3-+ CO2↑ полное ионно-молекулярное уравнение
Pb2++ CO32- + H2O= Pb(OH)2↓+CO2↑ сокращенное ионно-молекулярное уравнение
г) 2AlI3+3Na2SiO3=Al2(SiO3)3+6NaI молекулярное уравнение
2Al3++6I-+6Na++3SiO32-=Al2(SiO3)3+6Na++6I - полное ионно-молекулярное уравнение
2Al3+ +3SiO32-=Al2(SiO3)3 сокращенное ионно-молекулярное уравнение
a) FeCl2+KMnO4+HCl→FeCl3+…
Окислит.- восстанов. свойства |
Схема и название процесса |
Число электронов |
Наименьшее общее кратное |
Коэффи-циент |
Окислитель KMn04 |
восстановление MnO4-+8H++5ēMn+2+4H2O |
5 |
|
1 |
|
|
|
5 |
|
Восстано-витель FeCl2 |
окисление Fe2+– 1ē Fe3+ |
1 |
|
5 |
5FeCl2+KMnO4+8HCl→5FeCl3+KCl+MnCl2+4H2O
b) NaNO2+Cl2+NaOH→….
Окислит.- восстанов. свойства |
Схема и название процесса |
Число электронов |
Наименьшее общее кратное |
Коэффи-циент |
Окислитель Cl2 |
восстановление Cl2+2ē2Cl- |
2 |
|
1 |
|
|
|
2 |
|
Восстано-витель NaNO2 |
окисление NO2-+2OH-– 2ē NO3-+ H2O |
2 |
|
1 |
NaNO2+Cl2+2NaOH→NaNO3+2NaCl+ H2O
2.Раствор, содержащий 0.037 г / л гидроксида кальция, разбавлен в 10 раз. Во сколько раз изменится водородный показатель раствора?
Определим молярную концентрацию раствора до разбавления

При диссоциации 1 моль гидроксида кальция образуется 2 моль гидроксид ионов , следовательно концентрация гидроксид ионов равна:
[OH-]=0.0005*2=0.001 моль/л
Концентрации ионов водорода и гидроксид ионов связаны между собой уравнением:
Отсюда

при
разбавлении в 10 концентрация вещества
уменьшится в 10 раз и станет равной

При диссоциации 1 моль гидроксида кальция образуется 2 моль гидроксид ионов , следовательно концентрация гидроксид ионов равна:
[OH-]`=0.00005*2=0.0001 моль/л
Концентрации ионов водорода и гидроксид ионов связаны между. Следовательно

Т.о при разбавлении раствора гидроксида кальция в 10 раз рН раствора уменьшилось на 1, или уменьшился в 11/10=1,1 раза
3.Определить БЕЩ раствора содержащего 17,5 г/л гидроксида аммония и имеющего pH=9,2 и рКо=4,75 при250С.
Определим молярную концентрацию раствора:

БЕЩ -буферная емкость по щелочи характерна для буферных растворов, в данном случае дан гидроксид аммония, т.е дан аммиачный буферный раствор. Определим концентрация соли аммония в данном буферном растворе:





БЕЩ рассчитывается по формуле:
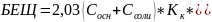
Определим константу кислотности. Константы основности и кислотности связаны через константу диссоциации воды: Kw =Kк* Kо Kw=10-14
Ко=10-рК=10-4,75=1,78*10-5

Тогда

вариант 28
