
- •Атомна і ядерна фізика
- •Історія виникнення вчення про будову атома.
- •Висновки з дослідів Резерфорда.
- •Квантові постулати н. Бора:
- •Ч астота випромінювання спектральних ліній атома гідрогену
- •Енергетичні стани атома гідрогену.
- •Види люмінесценції
- •Властивості рентгенівського випромінювання:
- •Застосування рентгенівських променів:
- •Властивості лазерного випромінювання:
- •Використання лазерів:
- •Види радіоактивності
- •Види радіоактивного випромінювання
- •Закони збереження, що виконуються під час ядерних реакцій:
- •Види ядерних реакцій
Атомна і ядерна фізика
Історія виникнення вчення про будову атома.
1833 рік – при вивченні законів електролізу встановив, що атом має складну структуру і що
всередині атома наявні електричні заряди
1897 рік – вивчаючи розряд в газах, Дж. Томсон відкрив електрон і виміряв його питомий заряд.
1909 рік – Р. Міллікен виміряв заряд електрона
1906 рік – Е.Резерфорд запропонував планетарну модель атома.
Д
 ослід
Резерфорда. Резерфорд зондував
атоми золота швидкими ядрами гелію
(
ослід
Резерфорда. Резерфорд зондував
атоми золота швидкими ядрами гелію
(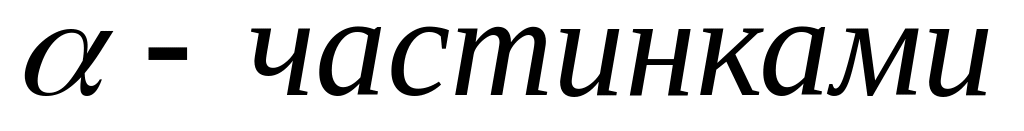 ),
які вилітали з радіоактивного джерела,
вміщеного в свинцевий контейнер.
Навпроти отвору в контейнері, на шляху
),
які вилітали з радіоактивного джерела,
вміщеного в свинцевий контейнер.
Навпроти отвору в контейнері, на шляху
 -
частинок, розташовувалась тонка золота
фольга. Навколо установки розташовувався
екран, покритий ZnSO4,
який у місті потрапляння частинки
починав світитись і давав змогу
фіксувати рух
-
частинок. Переважна кількість ядер
гелію проходила крізь фольгу не
помічаючи перешкоди, але деякі ядра
проходячи крізь фольгу, відхилялись
на значні кути, а незначна їх кількість
навіть відбивалась назад.
-
частинок, розташовувалась тонка золота
фольга. Навколо установки розташовувався
екран, покритий ZnSO4,
який у місті потрапляння частинки
починав світитись і давав змогу
фіксувати рух
-
частинок. Переважна кількість ядер
гелію проходила крізь фольгу не
помічаючи перешкоди, але деякі ядра
проходячи крізь фольгу, відхилялись
на значні кути, а незначна їх кількість
навіть відбивалась назад.
Висновки з дослідів Резерфорда.
В об’ємі атома (діаметр атома 10-10м) більшість простору порожня. Майже вся його маса (99%) сконцентрована в дуже малому ядрі (діаметром 10-15м)
Ядро атома має позитивний заряд, величина якого за модулем дорівнює сумарному заряду електронів в атомі
Кількість електронів в атомі дорівнює порядковому номеру елемента в таблиці Менделєєва.
Планетарна модель атома: в центрі атома знаходиться маленьке (в 100000 разів менше за атом) масивне (99% маси атома) позитивно заряджене ядро, а навколо ядра рухаються електрони. Сумарний заряд електронів дорівнює заряду ядра, тому загальний заряд атома дорівнює нулю.
Недоліки планетарної моделі атома: з електромагнітної теорії Максвела випливало, що електрони навколо ядра повинні рухатись з доцентровим прискоренням, а наявність прискорення свідчило про те, що електрони повинні випромінювати електромагнітні хвилі, втрачаючи енергію, і за розрахунками за час
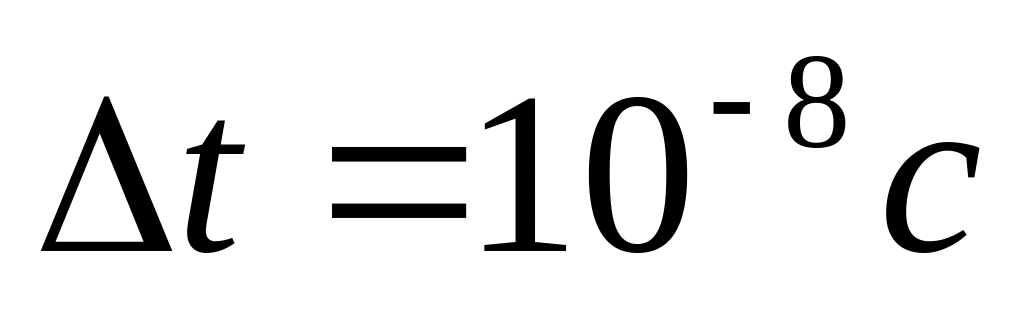 рухаючись по спіралі до ядра мусять
припинити свій рух (тобто атом мав
припинити своє існування). Насправді,
у не збудженому стані атоми не
випромінюють електромагнітні хвилі.
Крім того, пояснити існування лінійчатих
спектрів випромінювання модель атома
Резерфорда теж не змогла.
рухаючись по спіралі до ядра мусять
припинити свій рух (тобто атом мав
припинити своє існування). Насправді,
у не збудженому стані атоми не
випромінюють електромагнітні хвилі.
Крім того, пояснити існування лінійчатих
спектрів випромінювання модель атома
Резерфорда теж не змогла.
Квантові постулати н. Бора:
Електрон в атомі може перебувати тільки на певних стаціонарних (квантових) орбітах, випромінювання енергії електроном при цьому не відбувається. Кожна з таких орбіт має певний радіус
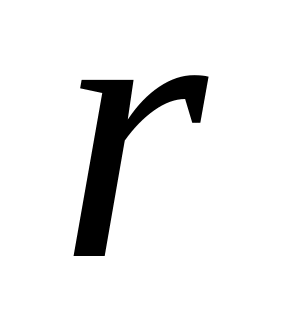 і характеризується певним значенням
енергії електрона
і характеризується певним значенням
енергії електрона
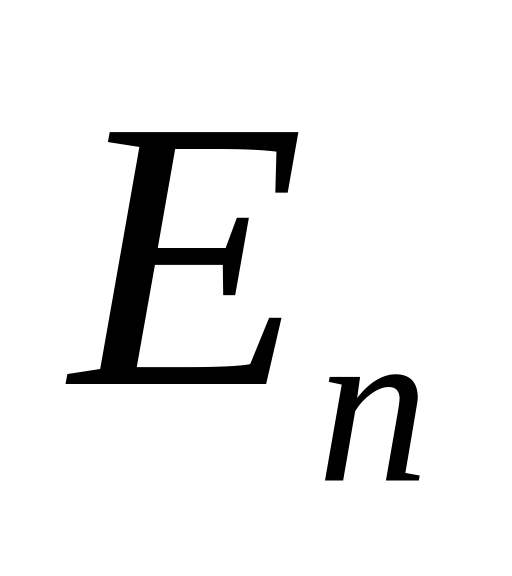
Випромінювання чи поглинання енергії атомом відбувається внаслідок переходу електрона з одного енергетичного рівня на інший. Частота випромінювання при цьому визначається за формулою
![]()
![]()
де
![]() ,
,
![]() - енергія електрона на орбітах за номером
- енергія електрона на орбітах за номером
![]() і
і
![]()
Момент імпульсу електрона
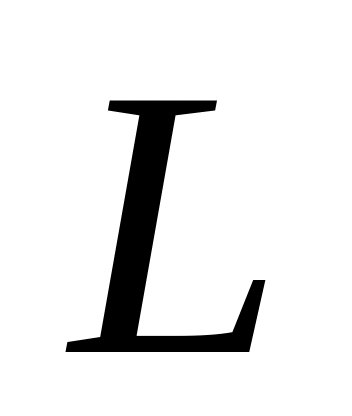 на
-ій
орбіті набуває дискретних значень,
тобто має бути рівним числу кратному
до сталої Планка
на
-ій
орбіті набуває дискретних значень,
тобто має бути рівним числу кратному
до сталої Планка
![]()
де
![]() -
маса електрона,
-
маса електрона,
![]() - швидкість електрона на
-ій
орбіті радіусом
- швидкість електрона на
-ій
орбіті радіусом
![]() ,
,
![]() - стала Планка,
- головне квантове число
- стала Планка,
- головне квантове число
