
- •1. Основні положення мкт. Ідеальний газ.
- •Основні визначення (тиск, густина, кількість речовини, константи й розмірність)
- •2) Число молекул у речовини;
- •3) Число молекул у речовини;
- •Кількість речовини можна знайти по формулі
- •2. Основне рівняння мкт, температура, середньоквадратична швидкість
- •Основне рівняння молекулярно-кінетичної теорії записується так:
- •Основне рівняння молекулярно-кінетичної теорії записується так:
- •Основне рівняння молекулярно-кінетичної теорії записується так:
- •Температура знизилася з до . Як змінилася при цьому середньоквадратична швидкість молекул?
- •1) Зменшилася в 2 рази;
- •3. Рівняння Менделеева-Клапейрона, газові закони
- •Рівняння Менделеева-Клапейрона має вигляд
- •Рівняння Менделеева-Клапейрона має вигляд
- •Рівняння ізобари має вигляд
- •4. Складні завдання на газові закони
- •5.Основні визначення статистики Максвелла
- •6. Знання формул для статистики Максвелла, середньоквадратична швидкість
- •7.Розподіл Больцмана (не скрізь знання формули)
- •1) ; 2) ; 3) Обидві формули вірні.
- •8. Довжина вільного пробігу молекули
- •9. Термодинаміка. Визначення. 1-е начало. Прості питання.
- •10.Перше начало термодинаміки для ізопроцесів. Складні формули. Задачі.
- •11.Теплоємність, адіабатний процес
- •12. Теплові машини
- •13. Друге начало термодинаміки. Ентропія
- •3. Обидві формули вірні.
- •3. Обидві формули вірні.
10.Перше начало термодинаміки для ізопроцесів. Складні формули. Задачі.
Для ізохорного процесу справедливо
1)
 ;
2)
;
2)
 ;
3)
обидві
формули справедливі.
;
3)
обидві
формули справедливі.
Для ізохорного процесу справедливо
1) ; 2) ; 1) обидві формули справедливі.
Для ізохорного процесу справедливо
1)
;
2)
; 3)
![]() .
.
Для ізотермічного процесу робота дорівнює
1) 1)
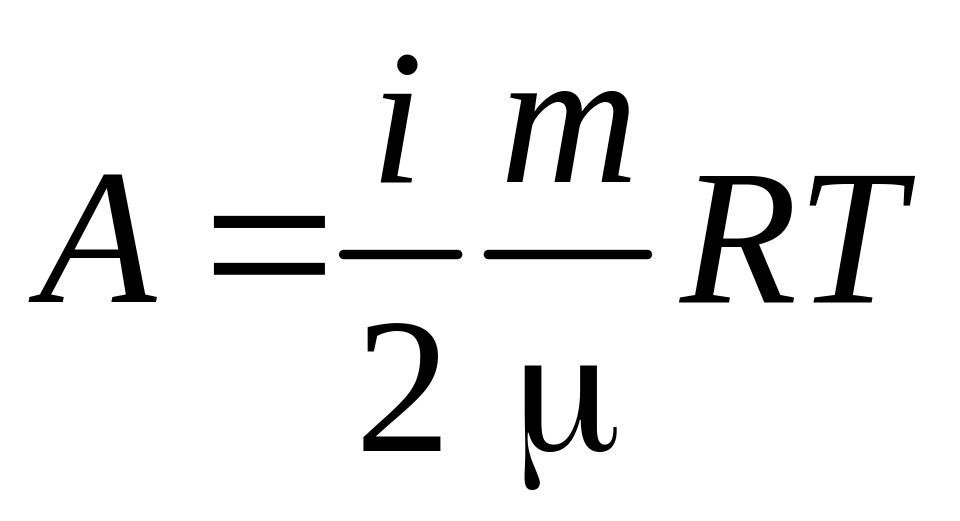 ;
2)
;
2)
 ; 3)
; 3)
 .
.
.
.
Робота при ізотермічному процесі визначається по формулі
1)
 ; 2)
; 2)
 ; 3)
; 3)
 .
.
Для изотермического процесса справедливо
1)
 ;
2)
; 3)
обидві
формули справедливі.
;
2)
; 3)
обидві
формули справедливі.
Для ізотермічного процесу справедливо
1)
; 2)
; 3)
 .
.
Для ізобарного процесу справедливо
1)
; 2)
; 3)
![]() .
.
Один моль одноатомного газу при ізохорному нагріванні одержав 500 Дж тепла. На скільки градусів змінилася його температура?
1) на 40 К; 2) на 50 К; 3) на 60 К.
Один моль одноатомного газу ізохорно нагріли на 160 К. Яку кількість тепла одержав цей газ?
1) 1 кДж; 2) 2 кДж; 3) 3 кДж.
Один моль одноатомного газу при ізобарному нагріванні одержав 600 Дж тепла. На скільки градусів змінилася його температура?
1) на 29 ДО; 2) на 39 ДО; 3) на 49 ДО.
Один моль одноатомного газу ізобарно нагріли на 180 К. Яку кількість тепла одержав цей газ?
1) 1,74 кдж; 2) 2,74 кдж; 3) 3,74 кдж.
Один моль двохатомного газу при ізохорному нагріванні одержав 700 Дж тепла. На скільки градусів змінилася його температура?
1) на 34 К; 2) на 46 К; 3) на 53 К.
Один моль трьохатомного газу при ізобарному нагріванні одержав 800 Дж тепла. На скільки градусів змінилася його температура?
1) на 24 К; 2) на 34 К; 3) на 44 К.
Один моль двохатомного газу ізохорно нагріли на 120 ДО. Яка кількість тепла одержав цей газ?
1) 2 кдж; 2) 2,6 кдж; 3) 2,9 кдж.
Один моль двохатомного газу при ізобарному нагріванні одержав 800 Дж тепла. На скільки градусів змінилася його температура?
1) на 27,5 К; 2) на 31,5 К; 3) на 38,5 К.
Один моль двохатомного газу ізобарно нагріли на 110 ДО. Яка кількість тепла одержав цей газ?
1) 2,7 кдж; 2) 3,2 кдж; 3) 3,6 кдж.
Один моль одноатомного газу при ізобарному нагріванні одержав 400 Дж тепла. На скільки змінилася його внутрішня енергія?
1) на 200 Дж; 2) на 240 Дж; 3) на 280 Дж.
Один моль одноатомного газу при ізобарному нагріванні одержав 700 Дж тепла. Яку роботу він зробив?
1) 280 Дж; 2) 300 Дж; 3) 320 Дж.
Один моль двохатомного газу при ізобарному нагріванні одержав 900 Дж тепла. На скільки змінилася його внутрішня енергія?
1) на 450 Дж; 2) на 600 Дж; 3) на 643 Дж.
Один моль двохатомного газу при ізобарному нагріванні одержав 300 Дж тепла. Яку роботу він виконав?
1) на 85 Дж; 2) 125 Дж; 3) 150 Дж.
11.Теплоємність, адіабатний процес
Молярна теплоємність - це
1) кількість теплоти, необхідна для нагрівання 1 моля речовини;
2) кількість теплоти, необхідна для нагрівання 1 моля речовини на 1 К;
3) кількість теплоти, необхідна для нагрівання 1 моля речовини на 1 К за 1 с.
Кількість теплоти, отримана системою при ізохорному нагріванні дорівнює
1)  ; 2)
; 2)
 ; 3)
; 3)
![]() .
.
Молярна теплоємність при ізотермічному процесі
1) наближається до нуля;
2) наближається до нескінченності;
3) наближається до одиниці.
Молярна теплоємність виміряється в
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Молярна теплоємність газу при ізохорному процесі дорівнює
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Молярна теплоємність газу при ізобарному процесі дорівнює
1) ; 2) ; 3) .
Молярна теплоємність водню при ізобарному процесі дорівнює

1)
![]() ; 2)
; 2)
![]() ; 3)
.
; 3)
.
Молярна теплоємність водню при ізохорному процесі дорівнює
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Молярна теплоємність гелію при ізобарному процесі дорівнює
1) ; 2) ; 3) .
Молярна теплоємність гелію при ізохорному процесі дорівнює
1)
![]() ; 2)
; 2)
![]() ; 3)
.
; 3)
.
Молярна теплоємність при постійному тиску залежить від температури газу відповідно до графіка (в області звичайних температур)
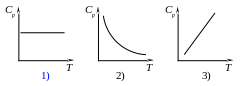
Молярна теплоємність при постійному об’ємі залежить від температури газу відповідно до графіка (в області звичайних температур)

Коефіцієнт Пуассона - це відношення
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Коефіцієнт Пуассона для гелію дорівнює
1) 1,33; 2) 1,66; 3) 2.
Коефіцієнт Пуассона для водню дорівнює
1) 1,4; 2) 1,6; 3) 1,8.
При адіабатичному процесі змінюються:
1) тиск, температура;
2) об’єм, температура;
3) тиск, об’єм, температура.
При адіабатичному розширенні газу
1) тиск збільшується, температура збільшується;
2) тиск зменшується, температура збільшується;
3) тиск зменшується, температура зменшується;
Рівняння Пуассона записується як
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Рівняння Пуассона записується як
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Адіабатним процесом не можна вважати
1) дуже швидке стиснення газу;
2) дуже повільний стиск газу;
3) дуже швидке розширення газу.
При адіабатному розширенні газу його температура
1) збільшується;
2) зменшується;
3) не міняється.
При адіабатному стисненню газу його температура
1) збільшується;
2) зменшується;
3) не міняється.
