
- •1. Основні положення мкт. Ідеальний газ.
- •Основні визначення (тиск, густина, кількість речовини, константи й розмірність)
- •2) Число молекул у речовини;
- •3) Число молекул у речовини;
- •Кількість речовини можна знайти по формулі
- •2. Основне рівняння мкт, температура, середньоквадратична швидкість
- •Основне рівняння молекулярно-кінетичної теорії записується так:
- •Основне рівняння молекулярно-кінетичної теорії записується так:
- •Основне рівняння молекулярно-кінетичної теорії записується так:
- •Температура знизилася з до . Як змінилася при цьому середньоквадратична швидкість молекул?
- •1) Зменшилася в 2 рази;
- •3. Рівняння Менделеева-Клапейрона, газові закони
- •Рівняння Менделеева-Клапейрона має вигляд
- •Рівняння Менделеева-Клапейрона має вигляд
- •Рівняння ізобари має вигляд
- •4. Складні завдання на газові закони
- •5.Основні визначення статистики Максвелла
- •6. Знання формул для статистики Максвелла, середньоквадратична швидкість
- •7.Розподіл Больцмана (не скрізь знання формули)
- •1) ; 2) ; 3) Обидві формули вірні.
- •8. Довжина вільного пробігу молекули
- •9. Термодинаміка. Визначення. 1-е начало. Прості питання.
- •10.Перше начало термодинаміки для ізопроцесів. Складні формули. Задачі.
- •11.Теплоємність, адіабатний процес
- •12. Теплові машини
- •13. Друге начало термодинаміки. Ентропія
- •3. Обидві формули вірні.
- •3. Обидві формули вірні.
1) ; 2) ; 3) Обидві формули вірні.
Барометрична формула має вигляд
1)
; 2)
; 3)
![]() .
.
Барометрична формула отримана з врахуванням
1) росту температури з висотою;
2) спаду температури з висотою;
3) незалежності температури від висоти.
Тиск газу з висотою
1) зменшується лінійно;
2) зменшується обернено пропорційно висоті;
3) зменшується експоненціально.
Тиск газу з висотою
1) зменшується гіперболічно;
2) зменшується обернено пропорційно висоті;
3) зменшується експоненціально.
На якому графіку правильно намальовані залежності P(h) для двох різних температур?
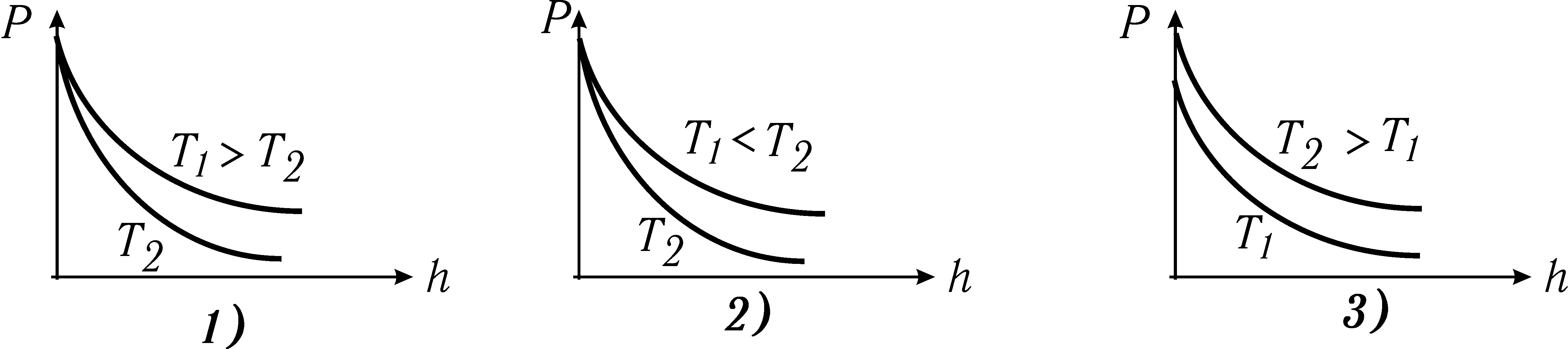
Тиск газу з висотою h зменшується, як показано на рисунку
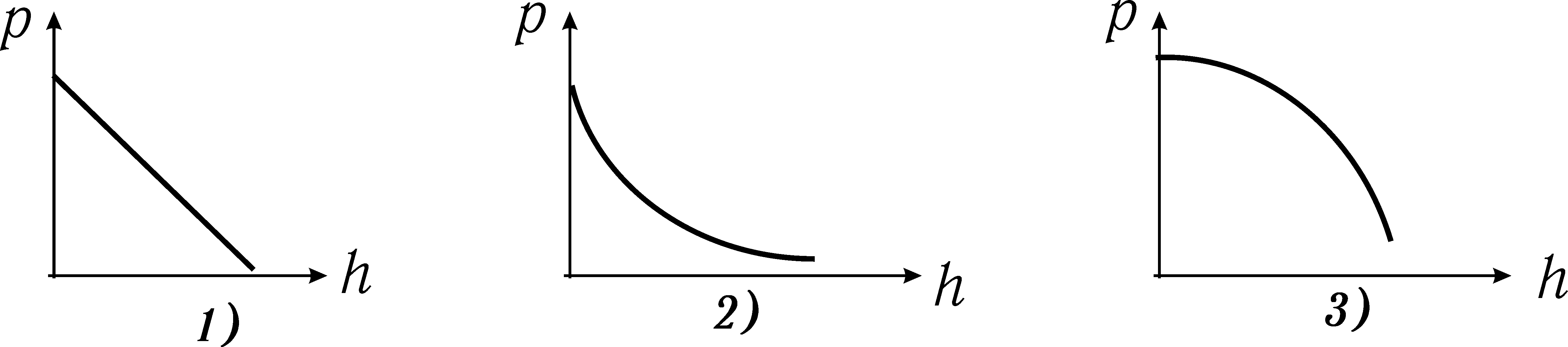
Графік функції розподілу Больцмана показаний на рисунку
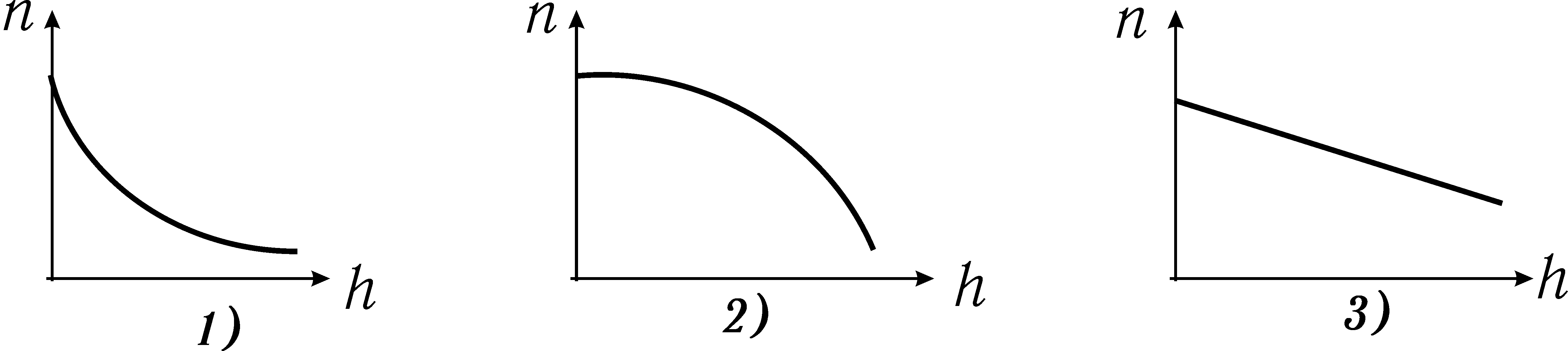
На якій висоті концентрація молекул водню при температурі
 зменшиться
в 2 рази?
Справка: молярнаа маса водню
зменшиться
в 2 рази?
Справка: молярнаа маса водню
 ,
універсальна
газова стала
,
універсальна
газова стала
 .
.
1) 11 км; 2) 89 км; 3) 206 км.
У скільки разів зменшиться концентрація молекул кисню при підйомі на висоту 5 км (молярна маса кисню
 ,
температура
)?
,
температура
)?
1) в 1,55 разів; 2) в 1,62 рази; 3) в 1,88 разів.
На якій висоті тиск повітря зменшиться в 2.7 рази (молярна маса повітря
 ,
температура
)?
,
температура
)?
1) 5,5 км 2) 7,9 км; 3) 8,7 км.
На якій висоті тиск повітря зменшиться в 2 рази (молярна маса повітря , температура )?
1) 4 км 2) 5 км; 3) 6 км.
Розподіл Больцмана для кисню (1) і водню (2) правильно показано на рисунку
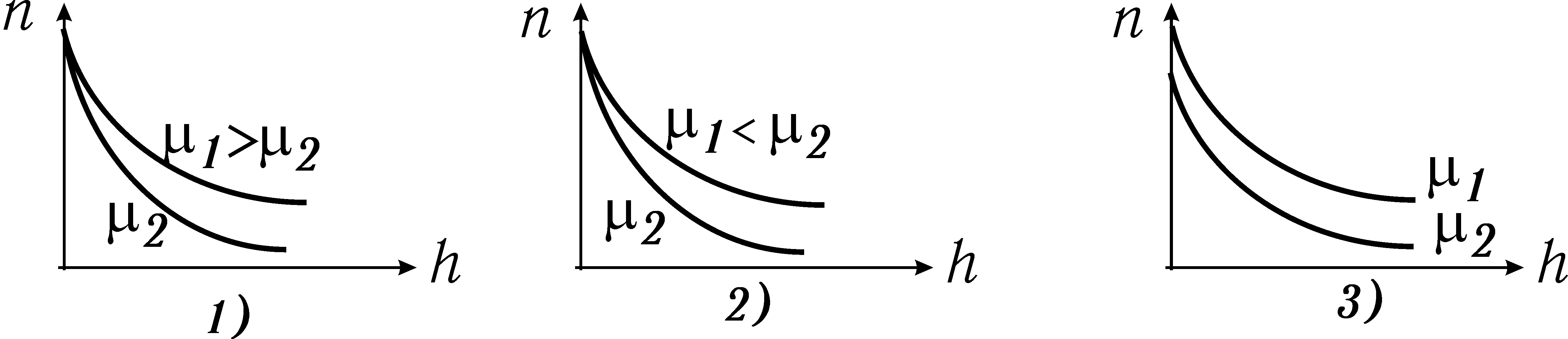
Зі збільшенням висоти, тиск кисню падає
1) швидше, ніж тиск водню;
2) повільніше, ніж тиск водню;
3) так само, як і тиск водню.
8. Довжина вільного пробігу молекули
Ефективний діаметр молекул - це
1) відстань, пройдена молекулою між двома зіткненнями;
2) відстань, на яке зближаються центри молекул при зіткненні;
3) кубічний корінь із об’єму, що доводиться на одну молекулу газу в посудині.
Довжина вільного пробігу молекули - це
1) середня відстань між молекулами;
2) середня відстань, що проходить молекула між двома зіткненнями;
3) середня відстань взаємодії молекул.
Довжина вільного пробігу залежить від тиску відповідно до рисунку
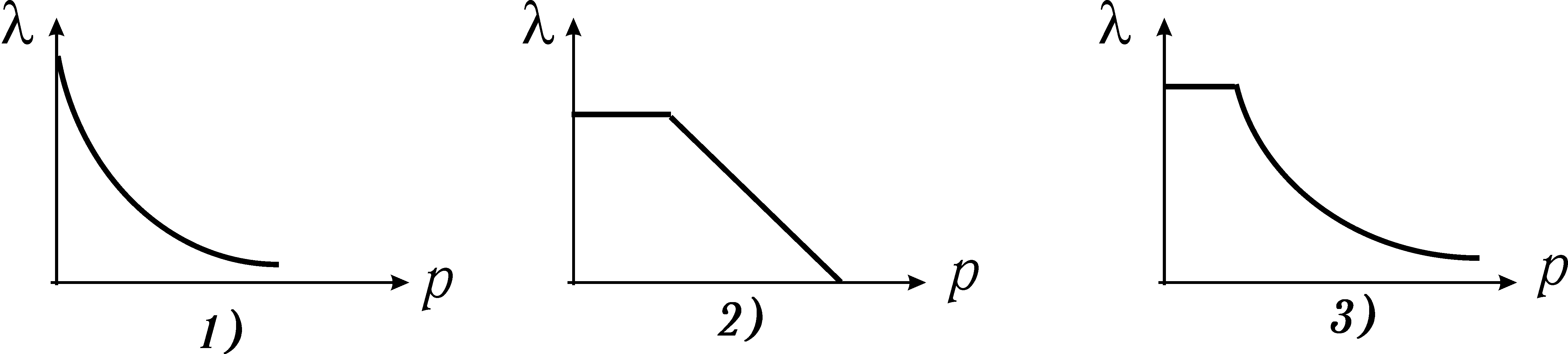
Довжина вільного пробігу молекули залежить від тиску як показано на рисунку
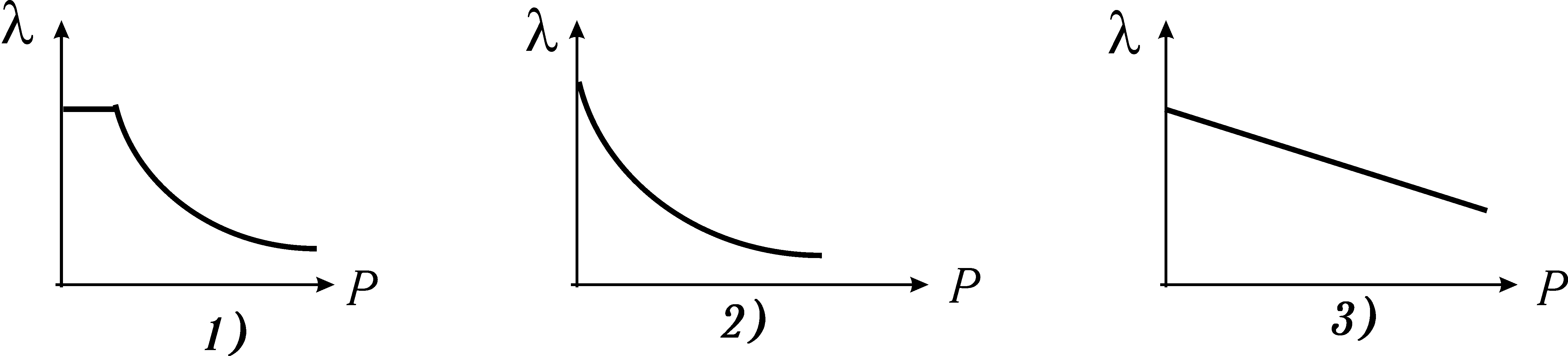
При даній температурі довжина вільного пробігу молекул
1) пропорційна тиску;
2) обернено пропорційна тиску;
3) обернено пропорційна кореню з тиску.
При даній температурі довжина вільного пробігу молекул
1) пропорційна концентрації молекул;
2) обернено пропорційна концентрації молекул;
3) обернено пропорційна кореню квадратному з концентрації молекул.
9. Термодинаміка. Визначення. 1-е начало. Прості питання.
Кількість теплоти - це
1) середня кінетична енергія молекул;
2) міра перетворення енергії хаотичного або спрямованого руху в енергію хаотичного руху;
3) міра внутрішньої енергії тіла.
Внутрішня енергія - це
1) середня кінетична енергія теплового руху молекул;
2) теплова енергія, одержувана системою при теплопередачі;
3) сума кінетичної й потенціальної енергії всіх молекул системи.
Робота в термодинаміку - це
1) міра перетворення енергії хаотичного або спрямованого руху в енергію хаотичного руху;
2) міра перетворення енергії хаотичного або спрямованого руху в енергію спрямованого руху;
3) міра зміни внутрішньої енергії тіла.
Число ступенів свободи молекули дорівнює
1) числу незалежних координат, що повністю описують положення молекули;
2) числу атомів у молекулі, помноженому на 3;
3) числу координатних осей, які можна провести через кожні два атоми в молекулі.
На кожний ступінь свободи молекули доводиться енергія
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Внутрішня енергія ідеального газу визначається по формулі
1)
 ; 2)
; 2)
![]() ; 3)
; 3)
 .
.
Елементарна робота, виконувана газом, визначається по формулі
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
 .
.
Робота, виконувана газом, визначається по формулі
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Зміна внутрішньої енергії
1) залежить від виду процесу, який виконує газ;
2) не залежить від виду процесу, який виконує газ;
3) залежить від зміни об’єму газу.
Визначення внутрішньої енергії як суми кінетичних енергій всіх молекул справедливо для
1) ідеального газу;
2) всіх газів;
3) усіх тіл.
Робота, яку виконує газ
1) залежить від виду процесу, який виконує газ;
2) не залежить від виду процесу, який виконує газ;
3)
дорівнює
![]() .
.
Внутрішня енергія ідеального газу залежить від температури відповідно до графіка

Перше начало термодинаміки можна записати так
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Перше начало термодинаміки можна сформулювати так
1) робота, що виконується системою, дорівнює сумі кількості теплоти, переданого системі й зміни внутрішньої енергії системи;
2) кількість теплоти, передана системі, іде на підвищення її внутрішньої енергії й здійснення над системою роботи;
3) кількість теплоти, передана системі, іде на здійснення системою роботи та зміну її внутрішньої енергії.
Робота при ізобарному процесі (площа під кривою) правильно зображена на графіку
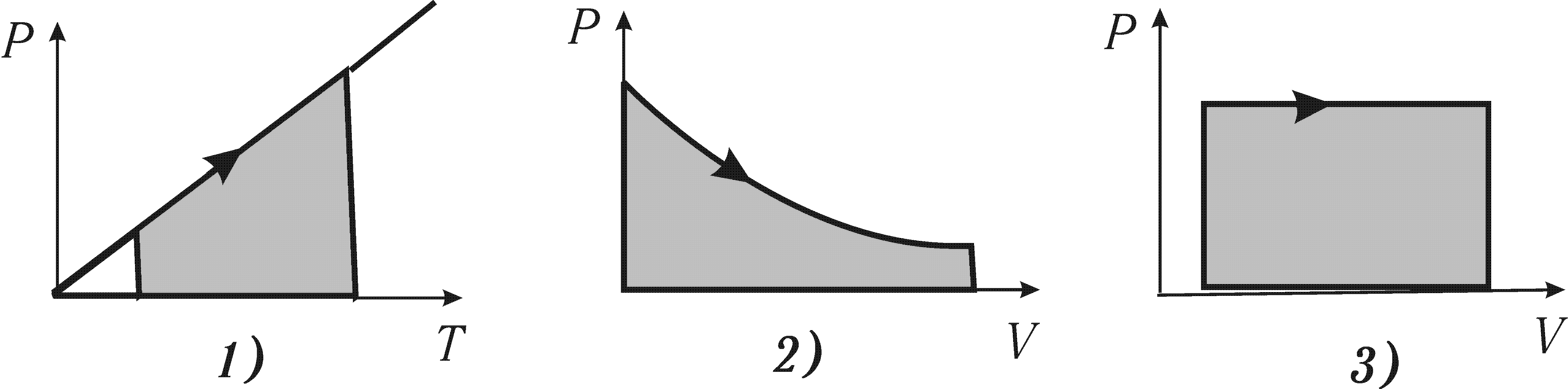
Для ізотермічного процесу перше начало термодинаміки виглядає так
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Для ізотермічного процесу справедливо
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Для ізохорного процесу перше начало термодинаміки виглядає так
1)
; 2)
![]() ; 3)
; 3)
![]() .
.
Для ізохорного процесу справедливо
1) ; 2) ; 3) .
Робота при ізобарному процесі дорівнює
1)
![]() ; 2)
; 2)
![]() ; 3)
; 3)
![]() .
.
Для ізохорного процесу
1) робота, що виконується системою, завжди більше зміни внутрішньої енергії;
2) робота, що виконується системою, завжди менше зміни внутрішньої енергії;
3) робота, що виконується системою, завжди дорівнює зміні внутрішньої енергії.
Для ізохорного процесу
1) кількість теплоти, передана системі, завжди більше зміни внутрішньої енергії системи;
2) кількість теплоти, передана системі, завжди менше зміни внутрішньої енергії системи;
3) кількість теплоти, передана системі, завжди дорівнює зміні внутрішньої енергії системи.
Для ізотермічного процесу
1) кількість теплоти, переданій системі, завжди більше роботи, що виконується системою;
2) кількість теплоти, переданій системі, завжди менше роботи, що виконується системою;
3) кількість теплоти, переданій системі, завжди дорівнює роботі, що виконується системою.
