
- •Министерство образования российской федерации кемеровский технологический институт пищевой
- •Часть 1
- •Введение
- •Рабочая программа
- •1 Цели и задачи дисциплины, ее место в учебном процессе
- •1.1 Цель преподавания дисциплины
- •1.2 Задачи изучения дисциплины
- •1.3 Знания и умения, которыми должны овладеть студенты после изучения дисциплины
- •2 Содержание дисциплины
- •Конспект лекций
- •1 Основы рационального питания
- •1.1 Биохимия пищеварения
- •Основы рационального питания. Энергетическая и пищевая ценность продуктов питания
- •Теории питания
- •2 Азотистые вещества и белки
- •Классификация белков, их строение
- •Белки как компоненты пищи
- •Пищевая ценность белка обуславливается:
- •Оптимальное содержание незаменимых аминокислот в 1 г.
- •Содержание белка в продуктах питания ,( % ):
- •2.3 Свойства белков и их превращения в технологических
- •Гидратация
- •Превращение белков в технологических процессах
- •Гниение белка
- •Превращения аминокислот
- •2.4 Ферменты
- •2. 5 Методы определения белков
- •3 Углеводы
- •3.1 Классификация, строение и свойства углеводов
- •Углеводы
- •3.2 Углеводы как компоненты пищи
- •3.3 Функции углеводов в пищевых продуктах и их превращения в технологических процессах
- •Превращения углеводов в технологических процессах.
- •Физические и физико-химические превращения углеводов. Клейстеризация крахмала.
- •Студнеобразующая способность пектиновых веществ.
- •Химические превращения. Карамелизация сахаров.
- •Ферментативные превращения. Гидролиз полисахаридов.
- •Гидролиз гликогена.
- •3.4 Методы определения углеводов
- •4 Липиды
- •4.1 Строение и классификация липидов
- •4.2 Липиды как компоненты пищи
- •4.3 Свойства и превращения липидов в ходе хранения и технологической переработки
- •Процесс гидрогенизации
- •Процесс гидролиза
- •3.4 Методы определения жира в пищевых продуктах и
- •Контрольные вопросы
- •5 Витамины
- •6 Минеральные вещества
- •7 Вода в сырье и пищевых продуктах
- •7.1 Значение воды для человеческого организма
- •7.2 Вода в пищевых продуктах
- •7.3 Активность воды и стабильность пищевых продуктов
- •7.4 Методы определения влаги в пищевых продуктах
- •8 Другие компоненты пищи.
- •9 Безопасность пищевых продуктов
- •9.1 Токсичные элементы
- •9.2 Радиоактивное загрязнение
- •9.3 Диоксины
- •9.4 Полициклические ароматические углеводороды
- •9.5 Вещества, применяемые в растениеводстве
- •9.6 Вещества, применяемые в животноводстве
- •9.7 Биологические загрязнители
- •9.8 Показатели безопасности пищевой продукции
- •9.9 Метаболизм чужеродных соединений
Процесс гидролиза
Под действием фермента липазы (кислот, щелочей) триглицериды гидролизуются с образованием сначала ди -, а затем моноглициридов и, в конечном итоге, жирных кислот и глицерина:
Н 2 С – О – С – R Н2 С – О Н
О
Н С – О – С – R1 +Н2 О Н С – О – С – R1 +Н2 О
О - RCOOH О - R2 COOH
Н2 С – О – С – R2 Н2 С – О – С – R2
О О
триглицерид диглицерид
Н2 С – ОН Н2 С – ОН
Н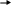 С – О – С – R1
+Н2
О Н С – ОН
С – О – С – R1
+Н2
О Н С – ОН
О - R1 COOH
Н2 С – ОН Н2 С – ОН
моноглицерид глицерин
На скорость гидролиза ацилглицерина влияют строение и положение ацилов, температура, катализаторы. С ростом длины углеродной цепи , увеличением ненасыщенности ацилов скорость гидролиза снижается. Гидролиз ацилглицеринов под действием липазы протекает ступенчато. При этом наблюдается определенная селективность, на первой стадии образуются 1,2 – ацилглицерины, на второй 2 – моноацилглицерины. Скорость гидролиза моноацилглицеринов выше, чем триацилглицеринов, диацилглицерины занимают промежуточное положение.
Гидролиз триацилглицеринов широко применяется в технике для получения жирных кислот, глицерина, моно- и диацилглицеринов.
Гидролитический распад жиров зерна, муки, крупы и других жиросодержащих пищевых продуктов является одной из причин ухудшения их качества, в конечном счете порчи. Особенно ускоряется этот процесс при повышении влажности хранящихся продуктов, температуры, активности липазы.
Процесс гидролиза сопровождается процессом окисления.
Процесс окисления.
Различают два вида окисления липидов:
автоокисление – кислородом воздуха;
биологическое окисление - под воздействием фермента липоксигеназы.
В настоящее время большое распространение получила разработанная академиком Н.Н. Семеновым цепная теория окисления жиров, дающая объяснение механизму этого процесса. По этой теории окисление связано с цепным развитием реакции через свободные радикалы, имеющие свободные валентности и обладающие повышенной реакционной способностью. Радикалы эти постоянно переходят в устойчивое валентно-насыщенное состояние. При этом они сами расходуются с образованием новых веществ и других свободных радикалов и атомов. Последние взаимодействуют в таком же порядке, т.е. этот процесс обуславливает протекание цепной реакции. Перекиси являются первичными продуктами окисления. До их образования реакции протекают очень медленно. По мере накопления перекисей последние создают начальные радикалы, зарождающие новые цепи. Это приводит к автоускорению процесса окисления.
Механизм окисления.
О2 О2
- СН2 - СН = СН - СН2 - - СН2 - СН = СН – СН* -
-ООН
фрагмент жирной кислоты радикал
- СН2- СН2 -
 - СН2
- СН = СН -
СН -
- СН2
- СН = СН -
СН -
перекисный радикал О - О *
- СН2 - СН = СН – СН - + - СН2- СН*-
ООН
гидропероксид радикал
При окислении образуются гидроперекиси. В этом случае окисление происходит не вследствие присоединения кислорода к двойной связи кислоты, а в результате отрыва водорода от метиленовой группы, расположенной по соседству с двойной связью.
СН3 (СН2)n СН – СН = СН (СН2) м СООН
О – ОН
Образование циклических перекисей происходит в результате присоединения кислорода по месту двойной связи кислоты
С Н3 (СН2)7 СН = СН (СН2)7 СООН + О2
СН3 (СН2)7 СН - СН - (СН2)7 СООН
О – О
Перекисные соединения неустойчивы. Они разлагаются под влиянием различных агентов с образованием вторичных, более устойчивых соединений – гидроксикислот, эпокисей, альдегидов, кетонов, сополимерных и других веществ. Например, при термическом распаде гидроперекисей в присутствии непредельных кислот в числе других продуктов образуются гидроксикислоты и эпокиси кислот по схеме:
R OOH + - CH = CH- ROH +- CH – CH –

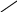
О эпокись
гидроксикислота
Гидроперекиси, гидроксикислоты и эпокиси кислот не имеют вкуса и запаха. Носителями неприятного вкуса и запаха окисленных жиров (прогорклых) являются кетоны, альдегиды и низкомолекулярные кислоты, образующиеся на последующих стадиях окисления жира – вторичные продукты окисления.
На процесс окисления влияют следующее факторы:
содержание ненасыщенных жирных кислот. Если скорость окисления насыщенной жирной кислоты принять за единицу, то ненасыщенная жирная кислота с одной двойной связью окисляется в 1000 раз быстрее, с двумя двойными связями – в 1200 раз быстрее. Ацилглицерины насыщенных кислот кислородом воздуха при обычных условиях практически не окисляются;
цис-формы жирных кислот окисляются быстрее, чем транс-формы;
свободные жирные кислоты окисляются значительно быстрее, чем кислоты, входящие в состав ацилглицеринов;
присутствие металлов переменной валентности ускоряет процесс Fe, Cu, Mg, Co, Ni.
чем выше температура, тем интенсивнее идет процесс;
окисление жиров происходит с поверхности, быстрее всего окисляется мономолекулярный слой. Скорость окисления тем выше, чем выше дисперсность среды, т.е. эмульсии окисляются быстрее;
лучистая энергия и ионизация ускоряют окисление;
наличие кислорода в среде ускоряет окисление;
б ольшое влияние на скорость окисления оказывают антиокислители (ингибиторы) – вещества, добавление которых приводит к обрыву цепей окисления. Пи этом прекращается существование активных радикалов, которые инициируют процесс окисления, с образованием высокостабильных радикалов, которые не участвуют в этом процессе. С(СН3)3 С(СН3)3

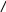
Н3С- ОН + Х* Н3С- -О* +НХ

С(СН3)3 С(СН3)3
Ионол – антиокислитель радикал ионола
где Х = ОН*, ОR*, OOH*
Среди антиокислителей наибольшее значение имеют соединения фенольной природы: ионол, бутилокситолуол, бутилоксианизол, пропилгаллаты. Из природных антиокислителей наибольшее значение принадлежит токоферолам. При введении антиоксидантов в количестве 0,01% стойкость жиров к окислению увеличивается в 10-15 раз. Активность и продолжительность действия антиоксидантов увеличивается в присутствии синергистов. Действие синергистов главным образом обусловлено способностью дезактивировать ионы металлов переменной валентности, играющих роль катализаторов окисления. Активными синергистами являются лимонная и аскорбиновая кислоты, фосфолипиды и др. соединения.
Окисление липидов может происходить и под действием биологических катализаторов – липоксигеназ. Ферментативное окислительное прогоркание характерно для липидного комплекса хранящихся масличных семян, зерна, продуктов их переработки (мука, крупа). Оно протекает при участии ферментов липазы и липоксигеназы.
Липаза осуществляет гидролиз триацилглицеринов, липоксигеназа катализирует образование гидропероксидов ненасыщенных жирных кислот (главным образом, линолевой и линоленовой)
В общем виде, этот процесс может быть представлен схемой:
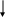 Триацилглицерины
Триацилглицерины
липаза
Жирные кислоты + глицерин + моно – и диацилглицерины
липоксигеназа
Гидропероксиды
и пероксиды
жирных кислот
Вторичные продукты
окисления
(альдегиды, кетоны и другие соединения)
При хранении растительные и животные жиры, жиросодержащие продукты под влиянием кислорода воздуха, света, влаги, ферментов постепенно приобретают неприятный вкус и запах. Некоторые из них обесцвечиваются. В них накапливаются вредные для организма человека продукты окисления. В результате снижается их пищевая и физиологическая ценность, при этом они могут оказаться непригодными для употребления (пищевая порча жиров). Наименее стойки при хранении сливочное масло, маргарин, куриный жир.
В отдельных случаях процессы гидролиза и окисления играют в технологии положительную роль. Например, при созревании муки, образующиеся в результате окисления перекисные соединения окисляют каротиноиды и укрепляют белки.
Созревание муки:
Мука перекись
Окисление каротиноидов окисление SH- связей в
белках до –S-S- мостиков
Посветление муки
Укрепление клейковины
