
- •Вопрос 1.
- •Вопрос 2.
- •Вопрос 3
- •Вопрос 4.
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7.
- •Вопрос 8.
- •Вопрос 9
- •Вопрос 10
- •Вопрос 11
- •Вопрос 12
- •Вопрос 13.
- •Вопрос 14
- •Вопрос 15
- •Вопрос 16.
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Вопрос 25
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •Вопрос 29
- •Вопрос 30
- •Вопрос 31
- •Вопрос 32
- •Вопрос 33
- •Вопрос 34
Вопрос 5
Реакции первого порядка. Период полупревращения.
V=+дельтаС/-дельтаt мгновенное значение скорости данной реакции. Следить будем по исходному веществу, соответственно знак «-».
Выражение для скорости имеет вид V=KC.
Приравнять правые части уравнений: - (дельтаС/дельтаt)=КС.
Вопрос 6
Реакции второго порядка. Период полупревращения.
Вопрос 7.
Влияние температуры на скорость реакции. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса. Эндотермические и экзотермические реакции.
Правило Вант-Гоффа – скорость большинства реакций увеличивается в 2-4 раза при увеличении температуры реакции на каждые 10 градусов. V2/V1=T2-T1/гамма^10. Если за скоростью реакции следят при одной и той же исходной концентрации реагирующих веществ и до одного и того же изменения концентрации (дельтаС), то уравнение T1/T1=гамма^T2-T1/10.
Более точную зависимость скорости реакции от температуры на основании экспериментальных данных вывел Аррениус.

Энергия активации (Ea) – минимальная энергия, которой должны обладать реагирующие молекулы, чтобы взаимодействие между ними стало возможным.
Если энергии выделяется больше, чем было затрачено на активацию химической системы, но химический процесс протекает с выделением энергии – экзотермическая реакция.
Если энергии выделяется меньше, чем энергия активации прямой реакции, то химический процесс протекает с поглощением теплоты – эндотермическая реакция.
Вопрос 8.
Если энергии выделяется больше, чем было затрачено на активацию химической системы, но химический процесс протекает с выделением энергии – экзотермическая реакция.
Если энергии выделяется меньше, чем энергия активации прямой реакции, то химический процесс протекает с поглощением теплоты – эндотермическая реакция.

Вопрос 9
Кинетика обратимых реакций. Химическое равновесие; выражение константы равновесия; сдвиг химического равновесия; принцип Ле Шателье.
Обратимые реакции – реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
С течением времени концентрация исходных веществ уменьшается, соответственно уменьшается скорость прямой реакции; концентрация продуктов возрастает => возрастает скорость обратной реакции. Наступает момент, когда скорости прямой и обратной реакции становятся равны – сколько молекул образуется в единицу времени, столько же их распадается. Такое состояние химической системы называется динамическим химическим равновесием.
Критерием достижения химического равновесия является неизменность концентраций участников химического процесса при неизменных внешних условиях (t,p). Концентрации, которые реализуются при химическом равновесии, разновесные концентрации (выделяются []).
V->=V<- k->Ca*Cb=k<-Ca*Cb
Из уравнение выделим постоянные величины – отношение констант скорости прямой и обратной реакции, полученное соотношение называется константой равновесия.
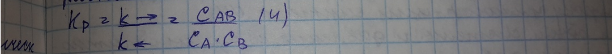
При изменении t, p, c происходит, так называемый, сдвиг химического равновесия –равновесие устанавливается при новых равновесных концентрациях. Направление сдвига – в сторону прямой или обратной реакции определяется принципом Ле Шателье. Если на химическую систему, находящуюся в равновесии, оказывается изменение (t,p,c), то равновесие смещается в сторону той из двух противоположной реакций, которая ослабляет производимое воздействие.
-Q+N2+3H2-2NH3+Q Kp=[NH3]/[N2][H2]^3
При повышении t равновесие смещается в сторону эндотермической реакции, при понижении температуру - в сторону экзотермической реакции.
Изменение давления.
Давление влияет только на химические процессы, в которых хотя бы один участник – газ. При повышении давления равновесие смещается в сторону образования меньше числа моль газа% при понижении – в сторону большего моль газа. Если в левой и в правой частях уравнений одинаковое число моль газа, то давление не влияет на смещение равновесия.
Изменение концентрации.
Увеличение концентрации любого участника смещает равновесие в сторону реакции расхода этого вещества, при уменьшении – в сторону образования этого вещества.
