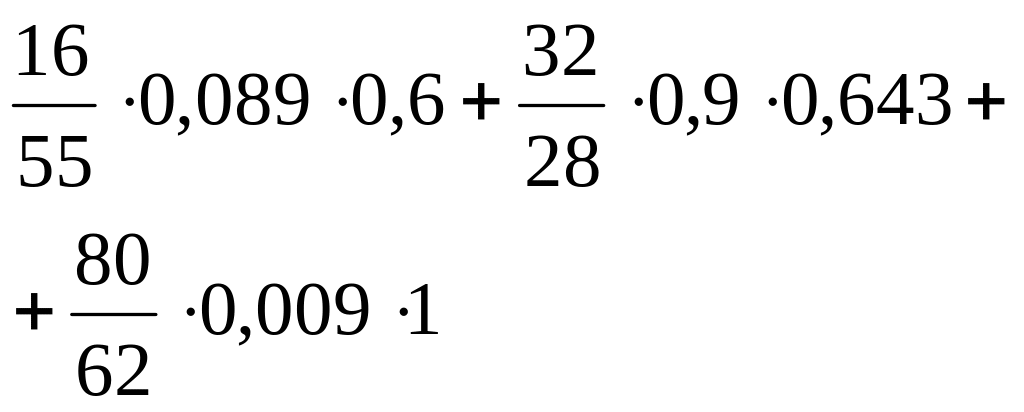- •Исходные условия доменной плавки
- •Химический состав шихтовых материалов
- •Коэффициенты распределения элементов
- •Состав чугуна
- •Уравнение по балансу основных и кислых оксидов
- •Составление уравнения теплового баланса
- •Теоретический выход шлака
- •Определение полезного расхода тепла на доменную плавку
- •Расход тепла на диссоциацию окислов и других соединений
- •Расход тепла на разложение гидратов и карбонатов
- •Расход природного газа
- •Составление балансовых уравнений
- •Определение количества углерода кокса, сжигаемого на воздушных фурмах
- •Количество отдельных компонентов в колошниковом газе
- •11. Газо-дутьевой режим
- •Шлаковый режим
- •Выход шлака
- •Состав шлака и его свойства
Уравнение по балансу основных и кислых оксидов
![]() (16)
(16)
где
![]() – избыток или недостаток основных
оксидов кальция и магния в данном
компоненте шихты, %, рассчитывается по
формуле
– избыток или недостаток основных
оксидов кальция и магния в данном
компоненте шихты, %, рассчитывается по
формуле
![]() (17)
(17)
где СаО, MgO, SiO2, Al2O3 – содержание данных оксидов в данном компоненте шихты, %;
![]() – количество диоксида кремния,
расходуемого на восстановление кремния.
– количество диоксида кремния,
расходуемого на восстановление кремния.
Получаем:
![]() ;
;
![]() ;
;
![]() .
.
Таким образом, уравнение по основности будет иметь вид:
1,264∙А+37,711∙Ф–7,890∙К=0 (18)
Составление уравнения теплового баланса
Уравнение по тепловому балансу имеет вид:
![]() (19)
(19)
где
![]() – тепловой эквивалент данного материала,
представляющий собой суммарный эффект
всех физико-химических превращений,
которым подвергается данный материал
массой в 1 кг или 1 м3 в процессе
доменной плавки с учетом потерь тепла.
– тепловой эквивалент данного материала,
представляющий собой суммарный эффект
всех физико-химических превращений,
которым подвергается данный материал
массой в 1 кг или 1 м3 в процессе
доменной плавки с учетом потерь тепла.
Вычисление тепловых эквивалентов доменной шихты, загружаемых на колошник доменной печи, и вдуваемого в горн печи газообразного, пылевидного и жидкого топлива осуществляется на основе общего теплового баланса доменной плавки. Составление баланса основано на предположении, что процесс восстановления осуществляется в две стадии: 1) диссоциация оксида на металл и газообразный кислород с затратой тепла, 2) окисление восстановителя (тв. углерода, оксида углерода, водорода) перешедшим в газ кислородом шихты, реакция окисления сопровождается положительным тепловым эффектом.
Теоретический выход шлака
Вычисляется по формуле:
![]() (20)
(20)
где Al2O3, СаО, MgO и т. д. – содержание соответствующих оксидов и элементов в рассматриваемом материале, %;
![]() и
и
![]() – пересчет Mn и Fe
соответственно в MnO и FeO;
– пересчет Mn и Fe
соответственно в MnO и FeO;
μMn, μFe, μS – коэффициент перехода марганца, железа, серы в шлак, доли.
 (21)
(21)
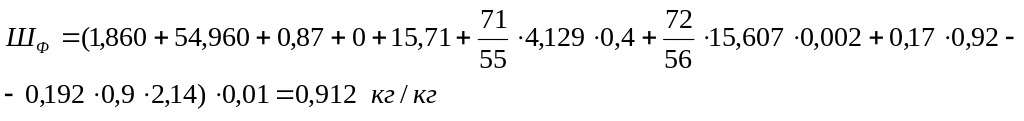 (22)
(22)
 (23)
(23)
Определение полезного расхода тепла на доменную плавку
Расход тепла на диссоциацию окислов и других соединений
Расход тепла определяется на основе термохимических данных следующих реакций:
FeO=Fe+0,5O2–4832 кДж/кг Fe,
Fe2O3=FeO+0,5O2–2554 кДж/кг Fe,
MnO=Mn+0,5O2–7388 кДж/кг Mn,
P2O5=2P+2,5O2–25066 кДж/кг P,
SiO2=Si+O2–31135 кДж/кг Si,
CaO+S=CaS+0,5O2–5426 кДж/кг S,
Теплота диссоциации оксидов и сульфидов, кДж/кг материала:
![]()
где FeO, Fe2O3, Fe и т. д. – содержание соответствующих элементов в данном шихтовом материале, %;
![]() и
и
![]() – доля железа соответственно в FeO
и Fe2O3.
– доля железа соответственно в FeO
и Fe2O3.
Принимаем, что оксиды железа находятся в свободном состоянии и весь оксид железа шихты входит в состав магнетита. В действительности часть FeO может находиться в виде фаялита (2FeO∙SiO2) и сидерита (FeCO3). Ввиду незначительного содержания фаялита в рудах и офлюсованном агломерате пренебрегаем небольшой разницей в теплотах образования фаялита и магнентита.
![]()
![]()
![]()
Расход тепла на разложение гидратов и карбонатов
Расход тепла на разложение на основе термохимических данных следующих реакций:
СаСО3=СаО+СО2–178500 или 178500/56=3188 кДж/кг СаО,
MgСО3=MgО+СО2–109870 или 109870/40=2747 кДж/кг MgО,
FeСО3=FeО+СО2–1571 кДж/кг Fe,
MnСО3=MnО+СО2–1571 кДж/кг Mn,
Теплоту выделения гидратной влаги (разложения гидратов) принимаем равной скрытой теплоте испарения воды (4200 кДж/кг Н2О).
Теплота разложения гидратов и карбонатов, кДж/кг материала:
![]() (28)
(28)
где СаО, MgO, Fe, Mn – содержание этих компонентов в карбонате, %.
![]() кДж/кг (29)
кДж/кг (29)
![]() кДж/кг (30)
кДж/кг (30)
![]() кДж/кг (31)
кДж/кг (31)
Расход тепла на испарение влаги шихты
![]() (32)
(32)
где Н2Охим и Н2Офиз – содержание влаги в соответствующем материале, %
![]() кДж/кг (33)
кДж/кг (33)
![]() кДж/кг (34)
кДж/кг (34)
![]() кДж/кг (35)
кДж/кг (35)
Расход тепла на нагрев чугуна
![]() (36)
(36)
![]() кДж/кг (37)
кДж/кг (37)
![]() кДж/кг (38)
кДж/кг (38)
![]() кДж/кг (39)
кДж/кг (39)
Расход тепла на нагрев шлака
![]() (40)
(40)
![]() кДж/кг (41)
кДж/кг (41)
![]() кДж/кг (42)
кДж/кг (42)
![]() кДж/кг (43)
кДж/кг (43)
Полезный расход тепла, кДж/кг материала:
![]() кДж/кг (44)
кДж/кг (44)
![]() кДж/кг (45)
кДж/кг (45)
![]() кДж/кг (46)
кДж/кг (46)
Расход тепла на нагрев газов выделяющихся из шихты
К этим газам относятся: пары воды и водорода, образующийся при частичном разложении гидратной влаги; диоксид карбонатов оксид углерода, образующийся при частичном разложении оксида флюса; газы, выделяющиеся из кокса (водород, метан, азот, оксид и диоксид углерода).
 где
где
![]() – степень разложения гидратной влаги,
доли единицы;
– степень разложения гидратной влаги,
доли единицы;
![]() – содержание этих элементов в коксе,
вес. %;
– содержание этих элементов в коксе,
вес. %;
![]() – теплоемкости этих газов при tк,
кДж/(м3∙ºС).
– теплоемкости этих газов при tк,
кДж/(м3∙ºС).
Таблица 11
Теплоемкости некоторых газов при различной температуре, кДж/(м3∙ºС)
Температура |
Н2О |
О2 |
СО2 |
СН4 |
|
ºС |
К |
||||
100 |
373 |
1,504 |
1,317 |
1,649 |
1,641 |
200 |
473 |
1,522 |
1,334 |
1,786 |
1,758 |
1000 |
1373 |
1,722 |
1,476 |
2,202 |
2,697 |
Степень разложения гидратной влаги принимаем =0. Степень разложения двуокиси углерода выделяющегося из карбонатов, следует принять равной нулю, т. к. применение показателя прямого восстановления по Павлову в расчетах связано со следующими показателями:
а) высшие оксиды железа и марганца восстанавливаются до закиси только косвенным путем;
б) закись марганца, кремнезем, окислы фосфора и другие трудновосстановимые окислы восстанавливаются только прямым путем;
в) вся углекислота карбонатов и летучих веществ шихты переходят в газ, не взаимодействуя с углекислотой кокса.
![]() кДж/кг (48)
кДж/кг (48)
![]() кДж/кг (49)
кДж/кг (49)
![]()
Характеристика вдуваемого в печь восстановительного газа
Тепло неполного горения природного газа
![]() кДж/кг (51)
кДж/кг (51)
Суммарное содержание углерода, водорода, кислорода и азота в природном газе
Т. к. мы приняли, что газ состоит из 100 % СН4, то рассчитываем только содержание углерода и водорода.
а) Суммарное содержание углерода:
![]() м3/м3 (52)
м3/м3 (52)
б) Суммарное содержание водорода:
![]() м3/м3 (53)
м3/м3 (53)
Расход влажного дутья
Водяные пары дутья в горне печи разлагаются по уравнению
Н2О=Н2+0,5О2–242800/22,4 кДж/м3 пара.
В объеме водяного пара содержится
половина объема кислорода, т. е. содержание
кислорода в единице влажного дутья
составит ω∙(1–f)+0,5f.
Следовательно, расход влажного дутья
на горение углерода природного газа по
реакции
![]() составляет:
составляет:
![]() (54)
(54)
Выход горнового газа
Из одного объема углерода получается один объем оксида углерода, объема водяного пара образуется объем водорода; в продукты горения перейдут водород и азот, содержащиеся в природном газе:
![]() (55)
(55)
Характеристика кокса, сгорающего перед воздушными фурмами
Тепло окисления углерода кокса, доходящего до фурм, кислородом дутья до оксида углерода
По реакции: С+0,5О2=СО+117940 кДж
Тепловой эффект горения составит:
WC=117940/12=9828,333 кДж/кг Сф.
Расход влажного дутья
![]() (56)
(56)
Выход горнового газа
![]() (57)
(57)
Определение теплосодержания дутья
![]() кДж/м3 (58)
кДж/м3 (58)
где
![]() – теплоемкости этих газов при tД,
кДж/(м3∙ºС).
– теплоемкости этих газов при tД,
кДж/(м3∙ºС).
![]() – тепло разложения влаги дутья, кДж/м3.
– тепло разложения влаги дутья, кДж/м3.
Расход восстановителей С, СО2 и Н2
Определение количества кислорода, переходящего в газ из шихты
Кислород, отнимаемый от высших оксидов железа и марганца и от части гидратной влаги:
Fe2O3=2FeO+0,5O2;
MnO2=MnO+0,5O2;
H2O=H2+0,5O2;
![]() (59)
(59)
Кислород, переходящий в газ при восстановлении оксида железа:
FeO=2Fe+0,5O2;
![]() (60)
(60)
Количество кислорода, отнимаемого при восстановлении трудновосстановимых оксидов до металлического состояния:
MnO=Mn+0,5O2–7388 кДж/кг Mn;
SiO2=Si+O2–31135 кДж/кг Si;
P2O5=2P+2,5O2–25066 кДж/кг P;
![]() (61)
(61)
Общее количество кислорода, переходящего в газ из восстанавливаемых оксидов:
![]() (62)
(62)
Кроме того, в газ переходит кислород диоксида углерода, карбонатов и летучих веществ кокса, а также кислород и оксид углерода летучих веществ:
![]() (63)
(63)
Общее количество газифицированного кислорода шихты:
![]() (64)
(64)
Результаты расчета представлены в таблице 12.
Таблица 12
Количество газифицированного кислорода шихты, кг/100 кг материала
Процесс |
Агломерат |
Флюс |
Кокс |
Fe2O3→FeO; MnO2→MnO; H2O→H2 |
|
|
|
O2(I) |
7,710 |
0,562 |
0,141 |
FeO→Fe |
|
|
|
O2(II) |
17,027 |
4,450 |
0,367 |
Восстановление Mn, P, Si |
|
|
|
O2(III) |
0,684 |
1,001 |
0,014 |
|
— |
— |
|
O2(4) |
— |
— |
0,196 |
Итого O2(Ш) |
25,421 |
6,013 |
0,522 |