
- •II. Расчетная часть задания
- •1. Общие сведения
- •2. Физико-химические свойства
- •3. Расчет характеристик горения
- •3.1. Определение характера свечения пламени
- •3.3. Уравнение реакции горения
- •2.1.Теоретический и практический расход воздуха на горение
- •2.3.Объем и состав продуктов полного сгорания
- •2.5.Стехиометрическая концентрация паров в смеси
- •2.6.Температура горения адиабатическая
- •3.Определение показателей пожарной опасности
- •3.1.Температура вспышки
- •3.2.Температура воспламенения
- •3.3.Температура самовоспламенения
- •3.4.Концентрационные пределы распространения пламени
- •3.5.Температурные пределы распространения пламени
- •3.6.Нормальная скорость распространения пламени паровоздушной смеси (максимальная нормальная скорость горения)
- •3.7.Критический диаметр огнегасящего канала и безопасного экспериментального максимального зазора
- •3.11.Мвск Минимальное взрывоопасное содержание кислорода
- •3.12.Максимальное давление взрыва
- •4.Расчет аварийной ситуации
- •Интенсивность испарения при заданных условиях
- •Время образования минимальной взрывоопасной концентрации паров в помещении
- •Избыточное давление взрыва газопаровоздушной смеси при выбранной аварийной ситуации
- •Размеры взрывоопасной зоны
- •4.6.Определение тротилового эквивалента взрыва паровоздушной среды
- •4.7.Определение радиусов зон разрушения
- •4.8.Исследование возможности снижения пожарной опасности помещения
- •Выбор и обоснование огнетушащих средств
- •СводнАя таблицА
- •Список использованной литературы
- •1. Основная
- •2. Дополнительная
- •3. Нормативно-техническая
2.5.Стехиометрическая концентрация паров в смеси
Объемная стехиометрическая концентрация паров в смеси:
стехобъем
=
![]() ,
% ,
,
% ,
где - стехиометрический коэффициент перед воздухом в реакции горения, = 10,5.
стехобъем
=
![]() = 1,96 %
= 1,96 %
Массовая стехиометрическая концентрация паров в смеси:
стехмасс
=
![]() ,
г/м3,
,
г/м3,
где М – молекулярная масса ксилола,
М (С8Н10 ) = 106 г/моль.
стехмасс
=
![]() = 92,8 г/м3.
= 92,8 г/м3.
2.6.Температура горения адиабатическая
Рассчитываем адиабатическую температуру горения
вещества при коэффициенте избытка воздуха α=1, без учета теплопотерь.
Определяем среднее теплосодержание продуктов горения:
Qср
=
![]() , кДж/м3;
, кДж/м3;
где VПГ – объём продуктов горения при = 1,
VПГ = V(СО2) + V(Н2О) + V(N2) = 11,09 м3/кг.
Qср
=
![]() кДж/м3.
кДж/м3.
По значению Qср с помощью таблиц “Теплосодержание газов при постоянном давлении”, ориентируясь на азот , приближенно определяем температуру горения Т1 = 2400 0С.
Рассчитываем теплосодержание продуктов горения при выбранной температуре Т1:
![]()
где Q1(CO2), Q1(H2O), Q1(N2)) – табличные значения теплосодержания газов при выбранной температуре Т1.
![]() кДж/кг;
кДж/кг;
Т.к. Q1ПГ > Qн (QПГ), то выбираем температуру Т2 = Т1 - 1000С .
Повторяем расчет теплосодержания продуктов горения при новой температуре Т2 = 23000С.
Q2ПГ
=![]() кДж/кг;
кДж/кг;
Т.к. Q2ПГ > Qн (QПГ), то выбираем температуру Т3 = Т2 - 1000С .
Повторяем расчет теплосодержания продуктов горения при новой температуре Т3 = 22000С.
Q3ПГ
=![]() кДж/кг;
кДж/кг;
Т.к. Q3ПГ > Qн (QПГ), то выбираем температуру Т4 = Т3 - 1000С .
Повторяем расчет теплосодержания продуктов горения при новой температуре Т4 = 21000С.
Q4ПГ
=![]() кДж/кг;
кДж/кг;
получили Q4ПГ < Qн< Q3ПГ.
Интерполяцией определяем температуру горения ТГ:
ТГ
=
Т4
+
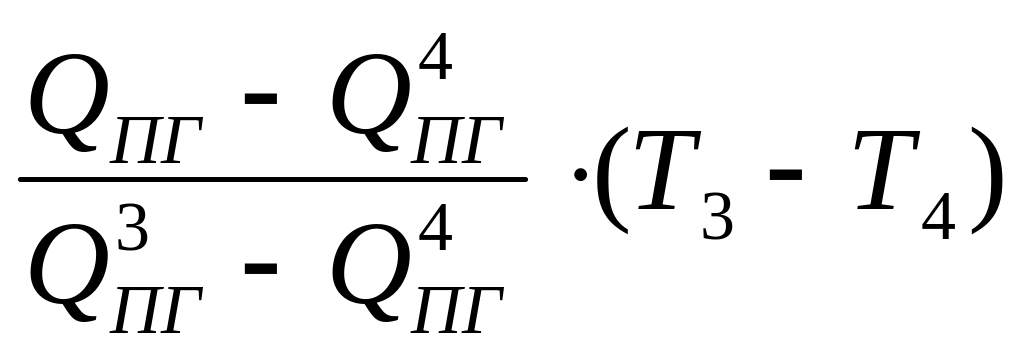 = 2100 +
= 2100 +
![]() 0С.
0С.
3.Определение показателей пожарной опасности
3.1.Температура вспышки
Температура вспышки в закрытом тигле.
Температуру вспышки жидкостей (tвсп) в °С, вычисляют по формуле
![]() ,
,
где а0 — размерный коэффициент, равный минус 73,14 °С;
a1 — безразмерный коэффициент, равный 0,659;
tкип — температура кипения исследуемой жидкости, С;
аj — эмпирические коэффициенты, приведенные в табл. 1;
lj — количество связей вида j в молекуле исследуемой жидкости.
Для ксилола: количество связей C=C – 6; С—Н = 10; С—С =2;
тогда tвсп = -73,14 + 0,659 *144,4+ (1,72*6 +1,105*10 – 2,03*2)=34,442С
Таблица 1
Вид связи |
aj, С |
Вид связи |
aj, С |
С—С |
—2,03 |
С—С1 |
15,11 |
С С |
—0,28 |
C—Br |
19,40 |
C=C |
1,72 |
С—Si |
—4,84 |
С—Н |
1,105 |
Si—H |
11,00 |
С—О |
2,47 |
Si— С1 |
10,07 |
С=О |
11,66 |
N—H |
5,83 |
C—N |
14,15 |
O—H |
23,90 |
CN |
12,13 |
S—H |
5,64 |
C—S |
2,09 |
P—O |
3,27 |
C=S |
—11,91 |
P=O |
9,64 |
C—F |
3,33 |
|
|
