
- •II. Расчетная часть задания
- •1. Общие сведения
- •2. Физико-химические свойства
- •3. Расчет характеристик горения
- •3.1. Определение характера свечения пламени
- •3.3. Уравнение реакции горения
- •2.1.Теоретический и практический расход воздуха на горение
- •2.3.Объем и состав продуктов полного сгорания
- •2.5.Стехиометрическая концентрация паров в смеси
- •2.6.Температура горения адиабатическая
- •3.Определение показателей пожарной опасности
- •3.1.Температура вспышки
- •3.2.Температура воспламенения
- •3.3.Температура самовоспламенения
- •3.4.Концентрационные пределы распространения пламени
- •3.5.Температурные пределы распространения пламени
- •3.6.Нормальная скорость распространения пламени паровоздушной смеси (максимальная нормальная скорость горения)
- •3.7.Критический диаметр огнегасящего канала и безопасного экспериментального максимального зазора
- •3.11.Мвск Минимальное взрывоопасное содержание кислорода
- •3.12.Максимальное давление взрыва
- •4.Расчет аварийной ситуации
- •Интенсивность испарения при заданных условиях
- •Время образования минимальной взрывоопасной концентрации паров в помещении
- •Избыточное давление взрыва газопаровоздушной смеси при выбранной аварийной ситуации
- •Размеры взрывоопасной зоны
- •4.6.Определение тротилового эквивалента взрыва паровоздушной среды
- •4.7.Определение радиусов зон разрушения
- •4.8.Исследование возможности снижения пожарной опасности помещения
- •Выбор и обоснование огнетушащих средств
- •СводнАя таблицА
- •Список использованной литературы
- •1. Основная
- •2. Дополнительная
- •3. Нормативно-техническая
№ вар |
Вещество |
Константы уравнения Антуана |
Диэлектр. прониц. |
tКИПЕНИЯ, 0С |
Н образ.кДж/моль |
Н исп.кДж/моль |
30. |
Циклогексанон С6Н10О |
lgр = 6,33089 – 1670,009/(230,312 + t) |
18,3 |
155,6 |
- 226 |
|
II. Расчетная часть задания
1. Общие сведения
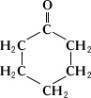
Вещество: циклогексанон С6Н10О.
Структурная формула
2. Физико-химические свойства
Циклогексанон С6Н10О - бесцветная жидкость с резким, напоминающим ацетон запахом; температура плавления tпл = - 40,2 °С; температура кипения tкип 155,6 °С, плотность 0,946 г/см3 (20 °C); диэлектрическая проницаемость ε = 18,3; ПДК в атм. воздухе 0,04 мг/м3, в воде водоемов 0,2 мг/л; теплота образования Н образ. = - 226кДж/моль; коэффициент молекулярной диффузии пара - 0,1*10-4 м2/сек; удельное электрическое сопротивление 10-13 – 10-4 Ом-1м-1.Растворяется в воде (~7% при 20 °С), смешивается с большинством органических растворителей, растворяет нитроцеллюлозу, ацетаты целлюлозы, жиры, воски, многие природные смолы, поливинилхлорид и др. В промышленности циклогексанон получают каталитическим окислением циклогексана (обычно образуется смесь с циклогексанолом) и каталитическим окислением циклогексанола; применяют главным образом как полупродукт для получения капролактама и адипиновой кислоты — сырья в производстве полиамидов — и как растворитель.
2.1. Расчет относительной плотности паров по воздуху (Dвозд)
Двозд=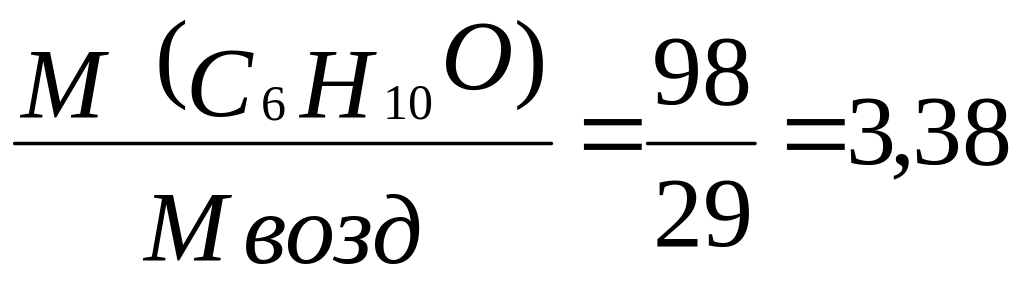
Молекулярная масса циклогексанона(С6Н10О):
![]() г/моль
г/моль
Молекулярная масса воздуха:
![]() =29
г/моль
=29
г/моль
2.2. Расчет плотности паров при нормальных условиях
пар = М(С6Н10)/Vм = 98*103/(22,4*10-3) = 4,375 кг/м3).
2.3. Расчет процентного элементного состава вещества.
С,% = (6*12)*100%/98 = 73,47;
Н,% = (10*1)*100%/98 = 10,20;
С,% = (1*16)*100%/98 = 16,33.
2.4. Расчет коэффициента горючести.
Коэффициент горючести рассчитывается по формуле:
К = 4 n(C) + 4 n(S) + n(H) + n(N) – 2 n(O) – 2 n(Cl) – 3 n(F) – 5 n(Br),
где n(C), n(S), n(H), n(N), n(O), 2 n(Cl), n(F), n(Br) – число атомов углерода, серы, водорода, азота, кислорода, хлора, фтора и брома в молекуле вещества.
В молекуле циклогексанона
n(C) = 6; n(Н) = 10; n(О) = 1.
К = 4 6 + 10 - 2 = 32; так как К > 1,циклогексанон – горючее вещество.
3. Расчет характеристик горения
3.1. Определение характера свечения пламени
Определяем исходя из элементного состава вещества.
1. Массовые доли углерода и водорода в молекуле ксилола составляют:
Мr (С8Н10) = 106;
(С) =
![]() =
90,5
%;
(Н) =
=
90,5
%;
(Н) =
![]() = 9,5
%.
= 9,5
%.
При горении веществ, содержащих более 75 % углерода, в зоне горения образуется настолько много частиц С, что поступающего путем диффузии воздуха не хватает для полного окисления всего углерода. Не окислившийся в пламени углерод выделяется в виде копоти, и пламя при горении таких веществ будет ярким и коптящим.
3.2..Низшая теплота сгорания
Рассчитываем по формуле Д.И. Менделеева:
QН = 339,4(C) + 1257(H) 108,9 [((O) +(N)) (S)] 25,1[9(H) +(W)], кДж/кг, где (С), (Н), (S), (О), (N) – – массовые доли элементов в веществе, %; (W) – содержание влаги в веществе, %.
QН = 339,4(C) + 1257(H) 25,19(H)] = 339,490,5 + 12579,5 –
- 25,1 9 9,5 = 40511 кДж/кг.
3.3. Уравнение реакции горения
С8Н10 + 10,5(О2 + 3,76N2) = 8СО2 + 5Н2О +10,53,76N2
