
13. Способ фиксирования тэ в перманганатометрии:
рН-индикатор;
металлоиндикатор;
безиндикаторный;
редокс-индикатор
14. Среда, в которой возможно комплексонометрическое определение Са2+ и Mg2+.
-
1. щелочная.
3. кислая.
2. нейтральная.
4. слабокислая.
15. Реакция образования комплексоната железа (III) при рН = 2
-
F
 e
3+
+ H2Y
2-
FeY
–
+ 2 H
+
e
3+
+ H2Y
2-
FeY
–
+ 2 H
+
Fe3+ + HY3- FeY– + H+
Fe3+ + Y4- FeY–
Fe3+ + H3Y- FeY– + 3 H+
F
 e
3+
+ H4Y
FeY
–
+ 4 H
+
e
3+
+ H4Y
FeY
–
+ 4 H
+
16. Точку эквивалентности в комплексонометрии фиксируют, …
-
примененяя специфический индикатор
безиндикаторным способом
применяя фенолфталеин
примененяя металлоиндикаторы
17. Комплексонатами называют ...
-
металлоиндикаторы
титранты в комплексонометрии
определяемые вещества в комплексонометрии
циклические комплексные соединения комплексонов с металлами
буферные растворы в комплексонометрии
18. Соли, вызывающие постоянную жесткость воды
-
1. CaCl2, BaCl2.
.
2. Na2SO4, MgSO4.
3. CaCl2, MgSO4.
4. K2CO3, CaCO3.
19. При добавлении избытка разбавленного раствора карбоната натрия к 50 см3 0,1 моль/дм3 раствора CaCl2 образуется осадок массой ____ г
0,5
0,25
0,75
1,0
20. Титрант и индикатор метода Фольгарда
1. Н2Y2– и К2Cr2O7 3. KSCN и K2CrO4
2. AgNO3 и крахмал 4. КSCN и FeNH4(SO4)212H2O
Билет № 6
1. Навеску гидроксида калия массой 28 г растворили и разбавили водой до объема 250 мл. Молярная концентрация эквивалентов КОН в полученном растворе составляет ________ моль/л. (с точностью до целого значения)
2
1
3
4
2. Точную мерную посуду применяют для … (несколько ответов):
-
приготовления рабочих растворов
приготовления стандартных растворов
отбора пробы исследуемого раствора
добавления растворов индикаторов
измерения объема растворов титрантов
3. Формула вещества, 0,01 М раствор которого характеризуется наибольшим значением рН, имеет вид
Fe(OH)2
NaOH
NaHCO3
Na2SO4
4. Соответствие метода, титранта и стандартного вещества:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5. NaCl |
5. При определении концентрации щелочи в растворе методом кислотно-основного титрования в качестве индикатора используется …
мурексид
фенолфталеин
эриохромовый черный
дифениламин
6. Объем раствора гидроксида натрия с молярной концентрацией эквивалентов 0,1 моль/л, необходимый для нейтрализации 15 мл раствора серной кислоты с молярной концентрацией эквивалентов 0,2 моль/л, равен ________ мл.
45
30
20
15
7. Значение рН 0,001 М раствора азотной кислоты ( = 1), равно……
1
2
0
3
8. Объем 0,1 моль/дм3 раствора HNO3, необходимый для нейтрализации раствора гидроксида бария, содержащего 0,171 г Ва(ОН)2, равен ____ см3 (ответ с точностью до целого значения)
9. При кислотно-основном титровании 100 мл минеральной воды, содержащей гидрокарбонаты кальция и магния, раствором соляной кислоты с молярной концентрацией эквивалента 0,05 моль/дм3 затрачено 13,90 см3 титранта. Рассчитать массу гидрокарбонат-ионов, содержащуюся в 1 л этого раствора.
10. Ацидиметрически можно оттитровать:
1. NaOH, . NH4ОН |
3. НCl |
5. Н2С2О4, FeSO4 |
2. NH4Cl, NaCl |
4. СН3СООNa, NaCl |
6. CaCl2, MgCl2 |
11. Задача протолитометрии, решаемая в присутствии индикатора, константа ионизации которого Кi = 1·10–5
-
1. NH4OH + НСl.
3. NaОН + Н2SO4.
2. НСl + КOH.
4. NaOH + НСООН.
12. Вещество, которое нельзя восстановить действием Na2S2O3.
![]() = + 0,09 В.
= + 0,09 В.
-
1. CO2;
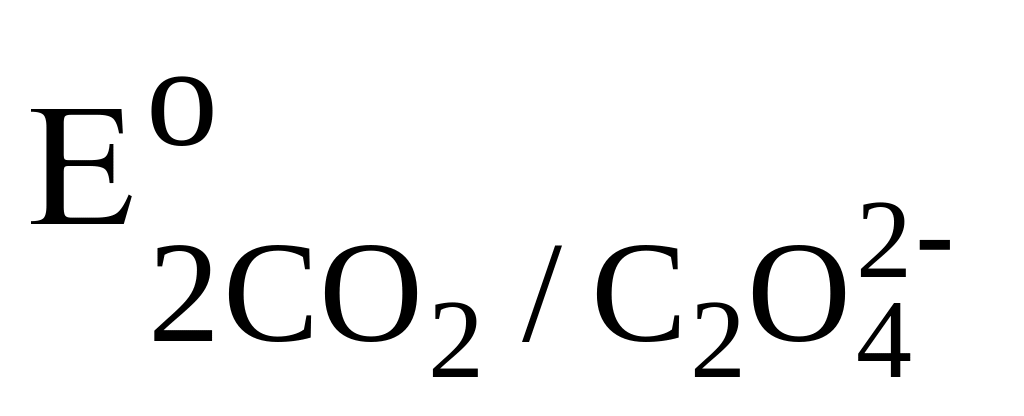 =
0,49 B.
=
0,49 B.2. I2;
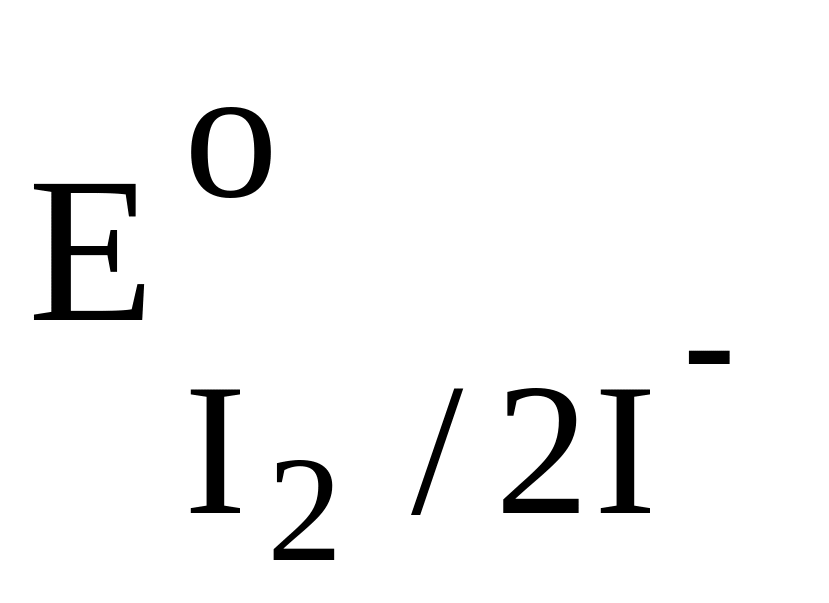 = + 0,54 B
.
= + 0,54 B
.3. FeCl3;
 =
+ 0,77 B.
=
+ 0,77 B.4. KMnO4; = + 1,51 B.
13. Найдите стехиометрический коэффициент перед окислителем в реакции
KMnO4 + FeSO4 + H2SO4 → MnSO4 + Fe2 (SO4) 3 + K2SO4 + H2O.
-
1. 10.
3. 2.
2. 1.
4. 5.
14. В аналитических лабораториях общую жесткость воды определяют методом ______________титрования.
кислотно-основного
окислительно-восстановительного
осадительного
комплексонометрического
15. Укажите правильную формулу комплексоната алюминия:
-
1 ООС–Н2С СН2 –СООNa
N–СН2 –СН2– N
NaООС–Н2С СН2 –СОО
Al
2. ООС–Н2С СН2 –СОО
N–СН2 –СН2– N
NaООС–Н2С СН2 –СОО
Al
3. NaООС–Н2С СН2 –СООAl
N–СН2 –СН2– N
AlООС–Н2С СН2 –СООAl.
4. НООС–Н2С СН2 –СООAl
N–СН2 –СН2– N
NaООС– Н2С СН2 –СООН .
16. Фиксирование точки эквивалентности при титровании сточной воды, содержащей ионы кальция, раствором комплексона III в присутствии аммонийного буферного раствора и индикатора эриохромового черного Т производят при достижении титруемым раствором …… цвета.
