
Число____________ ФИО______________________________
Билет № 1
1. Концентрация карбоната кальция в его насыщенном растворе составляет _____ моль/дм3 (ПРСаСО3= 4,9∙10–9)
1. 4,9∙10–9 3. 9,8∙10–9
2. 3,5∙10–5 4. 7,0∙10–5
2. Укажите ошибку при подготовке бюретки к работе
1. Закрепили в штативе
2. Ополоснули анализируемым раствором
3. «Носик» бюретки заполнили титрантом
4. Объем титранта установили на нулевой отметке
3. Титрант в кислотно-основном методе титрования (несколько вариантов):
1. Сильное основание
2. Сильная кислота
3. Слабая кислота
4. Сильный восстановитель
5. Комплексон ΙΙΙ
4. Укажите вещества по точной навеске которых можно приготовить стандартный раствор (несколько вариантов):
1. CH3COOH
2. NaOH
3. HCl![]()
4. H2C2O4·2H2O
5. K2Cr2O7
6. MgSO4
5. Рассчитайте навеску (m, г) NaCl, необходимую для приготовления 500 см3 0,1 моль/дм3 раствора.
6. Методом кислотно-основного титрования в растворе можно определить
1. NaCl 3. Na2C2O4
2. KNO3 4. K2SO4
7. Выберите титрант и индикатор для определения в растворе CH3COOH:
HCl и метиловый оранжевый
KOH и метиловый оранжевый
Na2B4O7 и фенолфталеин
KOH и фенолфталеин
8. На титрование 20 см3 раствора NaOH израсходовано 25 см3 раствора HCl c молярной концентрацией 0.08 моль/дм3 . Масса щелочи в 200 см3 этого раствора равна _____г.
1. 2,4 3. 3,2
2. 0,8 4. 1,6
9. Масса гидроксида калия, содержащего в 10 л его раствора, значение рН которого равно 11, составляет __________ г ( = 1).
0,56
0,28
0,112
0,56
10. Рассчитайте титр раствора щавелевой кислоты с молярной концентрацией эквивалента 0,05 моль/дм3.
11. Фиксирование точки эквивалентности при титровании раствора гидроксида калия раствором серной кислоты в присутствии метилового оранжевого производят при достижении титруемым раствором …… цвета.
1. розового
2. оранжевого
3. красного
4. желтого
12. ![]() = 1,51 В. Восстановить
= 1,51 В. Восстановить ![]() - в кислой
среде (ответ поясните) может…
- в кислой
среде (ответ поясните) может…
KBrO3;
 =
1,52 В
=
1,52 ВNa2C2O4;
 =
0,49 B
=
0,49 BH2O2;
 = 0,77 B
= 0,77 BNa2S4O8;
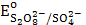 =
2,0 B
=
2,0 BF2;
 -=
2,87 B
-=
2,87 B
13. Продукты реакции FeSO4+KMnO4+H2SO4→
Fe2(SO4)3
MnSO4
MnO2
K2SO4
H2O
K2MnO4
Напишите уравнение реакции, расставьте коэффициенты.
14. Способ фиксирования ТЭ в перманганатометрии
применение специфического индикатора
безиндикаторное титрование
применение редокс-индикатора
применение фенолфталеина
15. Катионы,определяемые методом комплексонометрии
K+
Mg2+
H+
Ca2+
Na+
NH4+
16. Буферная смесь, применяемая в комплексонометрии, для поддержания pH>9
1. NH4OH+NH4Cl
2. CH3COOH+CH3COONa
3. HCOOH+HCOONa
4. C6H5OOH+C6H5OONH4
17. Соответствие между формулами комплексонов и их названиями:
-
1.

Двунатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА), комплексон III
2.

Нитрилотриуксусная кислота (НТУ), комплексон I
3.

Этилендиаминтетрауксусная кислота (ЭДТУ), комплексон II
18. Рассчитать объем раствора серной кислоты с концентрацией эквивалента 0,2 моль/дм3, затраченный на титрование 20 см3 раствора гидроксида калия с концентрацией 0,15 моль/дм3 (с точностью до точного значения).
19. Титрант и индикатор при определении хлорид-ионов в растворе методом Мора
1. AgNO3, Fe(III) 3. AgNO3, K2CrO4
2. I2, крахмал 4. KSCN, Fe(III)
Ответ пояснить уравнениями реакций.
20. При добавлении избытка раствора серной кислоты к 20 мл 0,1 М раствора ВаCl2 образуется осадок массой ________ мг.
0,233
0,208
0,416
0,466
Число__________________ Ф. И. О.__________________
Билет № 2
1. Концентрация
сульфата бария в его насыщенном растворе
составляет____ моль/дм3.
![]()
1. ![]() 3.
3. ![]()
2. ![]() 4.
4. ![]()
2. Для отбора пробы анализируемого раствора используют
1. Бюретку 3. Капельную пипетку
2. Пипетку Мора 4. Мензурку
3. Масса медного купороса, необходимая для приготовления 2 л 0,1 М раствора сульфата меди (II), составляет ________ г.
32
50
25
16
4. Какой объем воды (см3) необходимо добавить к 20 см3 0,1 моль/дм3 раствора уксусной кислоты, чтобы получить 0,05 моль/дм3 раствор?
-
17. 10.
19. 15.
18. 20.
20. 40.
5. Укажите соответствие между титриметрическим методом анализа и координатами кривой титрования
1. Осадительное титрование
Комплексонометрия
Кислотно-основное титрование
Редоксиметрия
рН - Vтитранта
Е - Vтитранта
рМе - Vтитранта
рCl - Vтитранта
6. Титрант метода кислотно-основного титрования
Сильный восстановитель
Сильное основание
Слабое основание
Слабый окислитель
Комплексон III
Иод
7. При титровании раствора молочной кислоты раствором NaOH используют индикатор:
Фенолфталеин
Метиловый оранжевый
Эриохромовый черный
Дифениламин
Ответ обоснуйте.
8. Для поддержания рН > 9 применяется буферная смесь:
CH3COOH + CH3COONa
NH4OH + NH4Cl
HCOOH + HCOONa
C6H5OH + C6H5OO NH4
9. Для 0,1 моль/дм3 раствора HCOOH рН составляет
1. 2,88 3. 1,38
2. 2,38 4. 1,0
10. Объем 0,1 М раствора HNO3, необходимый для нейтрализации раствора гидроксида калия, содержащего 0,084 г КОН, равен ________ мл.
84
42
15
150
11. На титрование 25 см3 раствора гидроксида калия затрачено 20 см3 раствора азотной кислоты с молярной концентрацией 0,1 моль/ дм3. Масса щелочи ( г ) в 500 см3 этого раствора равна
1. 1,12 3. 2,24
2. 5,6 4. 4,48
12. Скачок на кривой титрования в редоксиметрии при использовании в качестве индикатора эриоглауцина (Е0ind = 1,00 В) составляет
0,60….....1,00
0,80….....1,40
1,10….....1,31
0,60….....0,90
13. В иодометрии титрантами являются растворы…
I2
KI
Na2S2O3
KIO3
14. Комплексонометрическим методом можно определить в растворе:
Ca2+, Mg2+
Ca2+, Na2+
K+, Na+
Cu2+, K+
Написать уравнение реакции комплексообразования, находящейся в основе метода
15. Укажите метод и индикатор для определения жесткости воды
1. Кислотно-основное титрование, эозин
2. Комплексонометрия, эриохромовый черный Т
3. Йодометрия, крахмал
4. Аргентометрия, дихромат калия
16. При прямом комплексонометрическом титровании окраска раствора изменяется, потому что в конечной точке титрования протекает реакция…
Меn+ + Ind- = МеIndn-1
МеIndn-1 +H2Y2 - = MеYn-4 + HInd + H+
Меn+ + H2Y2- = MеYn-4 + 2H+
17. При разбавлении ацетатного буферного раствора значение величины рН…….
увеличится в 2 раза
уменьшится в 2 раза
уменьшится на 2
не изменяется
18. Объем 0,1 М раствора NаOН, необходимый для осаждения железа в виде гидроксида из 20 мл 0,05 М раствора нитрата железа (III), равен ________ мл (с точностью до точного значения).
19. Титрант и индикатор метода Фольгарда
1. AgNO3, K2CrO4 3 NH4SCN, K2CrO4
2. NH4SCN, NH4Fe(SO4)2 4. Na2S2O3, крахмал
20. Фиксирование точки эквивалентности при титровании сточной воды, содержащей бромид калия, раствором нитрата серебра в присутствии хромата калия в качестве индикатора производят при достижении титруемым раствором …… цвета.
1. достижении титруемым раствором красного цвета;
2. переходе цвета титруемой взвеси из белого в красный;
3. выпадении белого осадка;
4. достижении титруемым синего красного цвета.
Число________________ Ф.И.О.________________
Билет № 3
1. Укажите ошибки при работе с пипеткой (несколько ответов):
1. Отмыли от жира
2. Ополоснули титрантом
3. Выдули оставшуюся в ней каплю жидкости
4. По окончании работы промыли и поставили в штатив
2. Укажите соответствие между титриметрическим методом анализа и реакцией, находящейся в его основе:
Кислотно-основной
Редоксиметрический
Комплексонометрический
Осадительный
Ме2++Cl-= МеCl↓
Red1+Ox2=Ox1+ Red2
Ме2++Na2H2Y=Na2МеY+2H+
H++OH
 =H2О
=H2О
3. Масса кристаллогидрата (Na2CO3 ·10Н2О), необходимая для приготовления 500 г раствора карбоната натрия с массовой долей растворенного вещества 10,6%, составляет _________ г.
286
106
143
212
4. Раствор гидроксида бария массой 200 г и массовой долей растворенного вещества 17,1 % разбавили водой до объема 400 мл. Молярная концентрация эквивалентов Ва(ОН)2 в полученном растворе составляет ________ моль/л.
2
0,1
0,5
1
5. В процессе кислотно-основного титрования в растворе изменяется (несколько ответов):
pH
Е;
рК;
pМе;
рТ;
СН+;
6. Точка эквивалентности – это такой момент в процессе титрования, когда:
Индикатор поменял окраску;
Титрант и титруемое вещество прореагировали между собой в эквивалентных количествах;
Вещества прореагировали между собой в равных количествах;
Число моль – эквивалентов титранта и титруемого вещества обратно пропорционально;
7. Величина pH в точке эквивалентности больше 7 при титровании…
Сильной кислоты сильным основанием
Слабой кислоты сильным основанием
Сильного основания сильной кислотой
Слабого основания сильной кислотой
8 Аммонийный буферный раствор (укажите формулу) предназначен для поддержания:
1. рН=0 3. рН<7
2. рН>7 4. рН=7
9. Формулы солей, водные растворы которых можно различить, используя индикатор фенолфталеин, имеют вид:
1. FeSO4 и Na2SO4 3. Na2S и Na2SO4
2. FeSO4 и Al2(SO4)3 4. Na2S и Na2SO3
10. При кислотно-основном титровании 100 мл минеральной воды, содержащей гидрокарбонаты кальция и магния, раствором соляной кислоты с молярной концентрацией эквивалента 0,05 моль/дм3 затрачено 13,90 см3 титранта. Рассчитать массу гидрокарбонат-ионов, содержащуюся в 1 л этого раствора.
11. Задача протолитометрии, решаемая в присутствии индикатора, константа ионизации которого Кi = 1·10–9
-
1. NH4OH + НСl.
3. NaОН + Н2SO4.
2. НСl + КOH.
4. NaOH + НСООН.
12. Продукты реакции Н2С2O4+KMnO4+H2SO4→
СО2
MnSO4
MnO2
K2SO4
H2O
K2MnO4
Напишите уравнение реакции, расставьте коэффициенты.
13. Действием
азотной кислоты (![]() =
+ 0,94 В) можно окислить:
=
+ 0,94 В) можно окислить:
1.
Mn2+
;
|
3. F–;
|
2.
Br–;
|
4. I–;
|
