
- •Часть 1
- •Глава 1 Общие сведения об электропитании устройств связи 8
- •Глава 2 Трансформаторы 12
- •Глава 3 Аккумуляторы 18
- •Глава 4 Автономные источники питания 31
- •Глава 5 Выпрямление переменного тока 37
- •Предисловие
- •Введение
- •Глава 1 общие сведения об электропитании устройств связи
- •1.1 Современное состояние устройств электропитания. Перспективы развития
- •1.2 Понятие об электроустановке предприятия связи
- •1.3 Виды источников энергии, используемых для питания аппаратуры связи
- •Глава 2 трансформаторы
- •2.1 Общие сведения, классификация и принцип действия трансформатора
- •2.2 Силовые трансформаторы
- •2.3 Измерительные трансформаторы тока
- •2.4 Измерительные трансформаторы напряжения
- •2.5 Автотрансформаторы
- •2.6 Трехфазные силовые трансформаторы
- •Глава 3 аккумуляторы
- •3.1 Свинцовые аккумуляторы, общие сведения
- •3.2 Конструкция свинцовых аккумуляторов
- •3.3 Работа свинцового аккумулятора
- •3.4 Электрические параметры свинцовых аккумуляторов
- •3.5 Эксплуатация свинцовых аккумуляторов
- •3.6 Способы заряда свинцовых аккумуляторов
- •3.7 Неисправности свинцовых аккумуляторов
- •3.8 Меры безопасности
- •3.9 Щелочные аккумуляторы
- •3.10 Конструкция щелочного аккумулятора
- •3.11 Работа щелочного аккумулятора
- •3.12 Электрические параметры щелочных аккумуляторов
- •3.13 Эксплуатация щелочных аккумуляторов
- •3.14 Неисправности щелочного аккумулятора
- •3.15 Современные типы аккумуляторов
- •Глава 4 автономные источники питания
- •4.1 Общие сведения об автономных источниках питания
- •4.2 Гальванические элементы. Непосредственные преобразователи энергии
- •4.3 Термоэлектрические генераторы
- •4.4 Солнечные батареи
- •4.5 Атомные батареи
- •Глава 5 выпрямление переменного тока
- •5.1 Общие сведения
- •5.2 Основные параметры выпрямителей
- •5.3 Структурная схема выпрямителя
- •5.4 Однофазная мостовая схема выпрямления
- •Однофазная однополупериодная схема выпрямления
- •5.6 Однофазная двухполупериодная схема выпрямления
- •5.7 Трёхфазная однополупериодная схема выпрямления
- •5.8 Трёхфазная мостовая схема выпрямления
- •5.9 Особенности работы выпрямителей на нагрузку с индуктивной и емкостной реакцией
- •5.10 Схемы умножения напряжения
- •5.11 Импульсные выпрямители
- •Глава 6 управляемые выпрямители
- •6.1 Общие сведения о тиристорах
- •6.2 Структурная схема управляемого выпрямителя
- •6.3 Мостовая схема выпрямителя на тиристорах
- •6.4 Однофазная однополупериодная схема выпрямителя на тиристоре
- •6.5 Трёхфазный управляемый выпрямитель
- •6.6 Трёхфазный мостовой управляемый выпрямитель
- •6.7 Способы управления тиристорами в управляемых
- •Амплитудный способ управления включением тиристора
- •Фазовый способ регулирования
- •Фазоимпульсный способ регулирования
- •Глава 7 преобразователи напряжения постоянного тока
- •7.1 Общие сведения о преобразователях напряжения
- •7.2 Однотактный преобразователь напряжения постоянного тока
- •7.3 Двухтактный транзисторный преобразователь
- •7.4 Преобразователи на тиристорах
- •Глава 8 сглаживающие фильтры
- •8.1 Пульсации выпрямленного напряжения, возникновение пульсации выпрямленного напряжения и влияние её на работу аппаратуры связи
- •8.2 Общие сведения о сглаживающих фильтрах
- •8.3 Индуктивный фильтр
- •8.4 Ёмкостной фильтр
- •8.5 Индуктивно-ёмкостной г-образный lс-фильтр
- •8.6 Многозвенный lc-сглаживающий фильтр
- •8.7 Резонансные фильтры
- •8.8 Резистивно-ёмкостной фильтр
- •8.9 Активный фильтр
- •Глава 9 параметрические стабилизаторы напряжения переменного и постоянного токов
- •9.1 Общие сведения о стабилизаторах
- •9.2 Основные параметры
- •9.3 Параметрический стабилизатор переменного напряжения
- •9.4 Феррорезонансный стабилизатор напряжения переменного тока
- •9.5 Параметрический стабилизатор постоянного напряжения
- •9.6 Стабилизаторы тока
- •Глава 10 компенсационные стабилизаторы постоянного напряжения
- •10.1 Общие сведения о компенсационных стабилизаторах
- •10.2 Стабилизатор напряжения постоянного тока
- •10.3 Способы повышения качественных показателей компенсационного стабилизатора
- •10.4 Компенсационные стабилизаторы на интегральных микросхемах
- •Глава 11 импульсные стабилизаторы
- •11.1 Общие сведения об импульсных стабилизаторах
- •11.2 Принципиальные схемы силовой части импульсного стабилизатора
- •11.3 Двухпозиционный импульсный стабилизатор напряжения постоянного тока
- •11.4 Импульсный стабилизатор напряжения постоянного тока с шим
- •Литература
- •Электропитание устройств связи
- •3 44082, Г. Ростов-на-Дону, ул. Тургеневская, 10/6
Глава 3 аккумуляторы
3.1 Свинцовые аккумуляторы, общие сведения
Электрическим аккумулятором называется химический источник тока, в котором при заряде происходит преобразование электрической энергии в химическое вещество, длительно сохраняется и при необходимости может быть использовано.
При разряде аккумулятор преобразует химическое вещество и отдаёт электрическую энергию в нагрузку. Аккумулятор – это вторичный источник постоянного тока многоразового пользования.
Классификация аккумуляторов
В зависимости от состава электролита аккумуляторы бывают:
кислотные и щелочные.
В зависимости от конструкции бывают:
открытые и закрытые.
По назначению:
стационарные аккумуляторы С и СК;
стартерные аккумуляторы СТ;
радионакальные батареи РН;
мотоциклетные аккумуляторы;
железнодорожные аккумуляторы АБН.
3.2 Конструкция свинцовых аккумуляторов
Состоит из кислотоустойчивого сосуда (стекло, эбонит, пластик), заполненного электролитом (серная кислота и дистиллированная вода), в который помещают электроды (пластины – поверхностные, коробчатые или намазные), чтобы не было короткого замыкания, устанавливают сепарацию между пластинами.
Одноимённые пластины соединяют, увеличивая площадь пластин, отрицательных пластин на одну больше. Сосуд аккумулятора имеет нижнее пространство, чтобы выпадающая активная масса не замкнула пластины снизу, и верхнее пространство для регулировки уровня раствора электролита.
Для получения номинального напряжения питания аппаратуры связи аккумуляторы соединяют в блоки последовательно и располагают на стеллажах.
3.3 Работа свинцового аккумулятора
Аккумулятор преобразует при заряде электрическую энергию в химическое вещество и длительно сохраняет запасённую энергию. При необходимости отдаёт запасённую энергию.
Принцип действия аккумулятора основан на электролитической диссоциации серной кислоты в водном растворе.
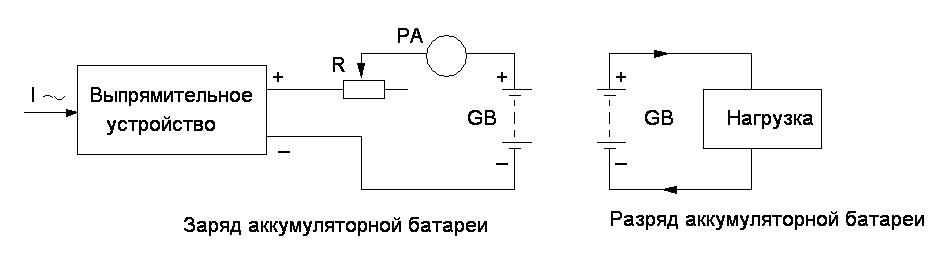
Рисунок 3.1 – Электрические схемы включения аккумуляторной батареи на заряд и разряд
Выпрямительное устройство преобразует переменный ток в пульсирующий ток для заряда аккумуляторной батареи. РА – прибор для контроля тока заряда. R – регулятор тока заряда батареи аккумуляторов.
При
включении выпрямителя
происходит заряд аккумуляторной батареи.
Под действием зарядного тока происходит
движение![]() ионов внутри аккумулятора, на положительной
пластине аккумулятора образуется
нейтральная молекула двуокиси свинца,
а на отрицательной пластине восстанавливается
губчатый свинец. Плотность электролита
повышается и достигает величины 1210
кг/м³ (измеряется ареометром). В конце
заряда батареи напряжение не изменяется
(измеряется вольтметром).
ионов внутри аккумулятора, на положительной
пластине аккумулятора образуется
нейтральная молекула двуокиси свинца,
а на отрицательной пластине восстанавливается
губчатый свинец. Плотность электролита
повышается и достигает величины 1210
кг/м³ (измеряется ареометром). В конце
заряда батареи напряжение не изменяется
(измеряется вольтметром).
Основная химическая реакция:
Положительная Положительная
пластина пластина
↓ разряд→ ↓
PbO2 + Pb + 2H2SO4 = PbSO4 + PbSO4 + 2H2O
↑ ←заряд ↑
Отрицательная Отрицательная
пластина пластина
Кроме основной химической реакции в аккумуляторе происходят побочные реакции и в конце заряда, проходящий ток разлагает воду электролита на водород и кислород, которые могут образовать гремучий газ («кипение»).
При подключении нагрузки аккумулятор начинает разряжаться. Происходит движение электронов во внешней цепи нагрузки и движение ионов внутри аккумулятора. На положительной и отрицательной пластинах образуется сульфат свинца, плотность раствора электролита уменьшается. Глубокий разряд аккумулятора запрещён, образуются крупные кристаллы вещества, сокращается количество вещества, участвующего в химической реакции.
Достоинства: высокая надёжность, малое внутреннее сопротивление, отдает в нагрузку постоянный ток.
Недостатки: низкий коэффициент полезного действия, большой вес и габариты, высокая стоимость, необходимо специальное помещение.
Применение: в качестве резервного источника питания при аварии.
