
- •Учреждение образования «Международный государственный экологический университет имени а.Д.Сахарова»
- •Список сокращений
- •Содержание
- •Раздел 1. Обзор литературы …………………………………………… 8-36
- •Глава 1. Метилирование днк у млекопитающих …………………………… 8-10
- •Глава 2. Метилирование днк: биохимия …………………………................ 13-18
- •Глава 3. Биологическое значение метилирования днк ……………………. 19-22
- •Глава 4. Роль метилирования днк в канцерогенезе ……………………….. 23-36
- •Раздел 2. Материал, методология и методики ………............ 37-45
- •Глава 1. Метилирование днк: методы исследования ……………..……........... 37
- •Введение
- •Обзор литературы
- •1. Метилирование днк у млекопитающих
- •1.1 Метилирование днк: общие сведения
- •1.2 Метилирование днк генома млекопитающих
- •1.3 Распределение CpG динуклеотидов в геноме человека
- •1.6 Метилирование одиночных CpG-динуклеотидов
- •2. Метилирование днк: биохимия
- •2.1 Ацетилирование гистонов
- •2.3 Необходимость метилирования днк у эукариот
- •2.4 Dnmtl: днк-метилтрансфераза 1 белок и Dnmt3: днк-метилтрансфераза 3 белок
- •2.5 Метилирование генома как динамический процесс
- •2.6 Метилирование днк: влияние на структуру хроматина
- •3. Биологическое значение метилирования днк
- •3.1 Импринтинг: общебиологический аспект
- •3.2 Регуляция метилирования днк в эукариотических клетках
- •3.3 Метилирование днк во время эмбриогенеза
- •3.4 Регуляция экспрессии с помощью метилирования днк
- •4. Роль метилирования днк в канцерогенезе
- •4.1 Мутации метилированной днк
- •4.2 Региональное гиперметилирование в опухолях
- •4.3 Роль метилирования при канцерогенезе
- •4.4 Нарушения метилирования днк при канцерогенезе
- •4.5 Опухолевые клетки: свойства и метилирование днк
- •4.6 Метилирование CpG-островков в геноме опухлевых клеток
- •4.7 Полное гипометилирование генома и локальное гиперметилирование. Их роль. 5-МеС как эндогенный мутаген
- •4.8 Гены инактивированные метилированием в опухолях
- •Материал, методология и методики
- •1. Метилирование днк: методы исследования: общие сведения
- •1.1 Выделение днк
- •1.2 Бисульфитный метод и постановка амплификации. Определние гиперметилирования генов pten, mgmt, p16.
- •Заключение
- •Список использованных источников
1.6 Метилирование одиночных CpG-динуклеотидов
Степень метилирования одиночных CpG-динуклеотидов варьирует в широких пределах и может быть различной в разных клетках и тканях. Метилирование в этом случае не оказывает широкомасштабного влияния на структуру хроматина, как это происходит в случае метилирования CpG-островков, а действует относительно локально, препятствуя связыванию факторов транскрипции, и в специализированных клетках может иметь тканеспецифичный характер. Примерами такого сайт-специфичного метилирования и связанного с ним подавления транскрипции может быть ситуация с промотором GK-интерферона и участком связывания CREB в промоторе гена бета-глобина. Очевидно, однако, что репрессирующая роль метилирования одиночных CpG-динуклеотидов в случае тканеспецифических генов ограничивается теми из них, в регуляции которых участвуют чувствительные к метилированию факторы транскрипции. Это положение продемонстрировано недавно в экспериментах, где было показано, что у дефицитных по ДНК-метилтрансферазе мышиных эмбрионов деметилирование ДНК не приводит к несвоевременной или эктопической активации исследованных тканеспецифичных генов. По-видимому, в экспрессии значительной части тканеспецифичных генов метилирование не играет существенной роли и она контролируется другими механизмами.
2. Метилирование днк: биохимия
2.1 Ацетилирование гистонов
Ацетилирование гистонов играет важную роль в модуляции структуры хроматина при активации транскрипции, увеличивая доступность хроматина для транскрипционного аппарата.
Известно, что ацетилированные гистоны признак транскрипционно активного хроматина. Но является ли ацетилирование причиной или следствием активации транскрипции? Сейчас более склонны думать, что это одна из причин. Гистоны целенаправленно модифицируются на тех промоторах, которые требуется активировать. При этом определенные остатки лизинов подвергаются ацетилированиям и деацетилированиям с помощью ферментов ацетилтрансфераз и деацетилаз. Полагают, что ацетилированные гистоны менее прочно связаны с ДНК и поэтому транскрипционной машине легче преодолевать сопротивление упаковки хроматина. В частности ацетилирование может облегчать доступ и связывание факторов транскрипции к их элементам узнавания на ДНК. Сейчас идентифицированы ферменты, которые осуществляют процесс ацетилирования и деацетилирования гистонов.
В дрожжах с процессами ацетилирования гистонов связан сложный ацетилтрансферазный комплекс SAGA. В него входит более 20 различных белков, в том числе и гистоноподобные TAF .
Уровень ацетилирования необходимый для облегчения транскрипции низок. 12 ацетилированных лизинов на гистоновый октамер усиливает транскрипцию хроматина in vitro на порядок. Помимо ослабления структуры хроматина, ацетилирование, возможно облегчает взаимодействие ацетилированных нуклеосом с другими факторами, участвующими в ремоделировании хроматина или с компонентами транскрипционного аппарата.
Таким образом осуществляется комбинаторный эффект: с одной стороны ацетилирование-деацетилирование прямо влияет на структурную подвижность хроматина, а сдругой стороны оно влияет на белок-белковые взаимодействия разных факторов с белками хроматина.
Ацетилирование остатков лизина в N-концевых "хвостиках" гистонов H2A, H2B, HЗ и H4 нейтрализует их положительный заряд и соответственно блокирует ассоциацию с витками нуклеосомной ДНК. Это, в свою очередь, декомпактизует структуру как самой нуклеосомы , так и хроматина в целом и, кроме того, освобождает внешнюю поверхность витков ДНК для взаимодействий с регуляторными факторами. Степень ацетилирования гистонов определяется активностью двух типов ферментов - гистонацетилтрансфераз HAT, и деацетилаз HDAC. Ряд активаторов и коактиваторов транскрипции (в частности, такой важный, как CBP/300 , участвующий в регуляции клеточного роста, дифференцировки, репарации ДНК и апоптоза), а также некоторые субъединицы базального аппарата транскрипции (ТАF11250) обладают гистонацетилтрансферазной активностью. Напротив, репрессоры транскрипции (такие, как Mad и ядерные рецепторы ) ассоциированы с деацетилазной активностью. В регуляцию транскрипции вовлекается также и ковалентная модификация ДНК. И эти две модификации белков и ДНК тесно переплетаются.
2.2 ДНК-метилтрансферазы
У высших эукариот метилирование остатков цитозина в положении 5 с образованием 5- метилцитозина катализируется ферментами ((цитозин-5)-ДНК-метилтрансферазами), которые обнаружены у прокариот и эукариот. Каталитический механизм действия этих ферментов изучен на примере бактериальной метилазы M.HhaI, которая модифицирует соответствующий сайт рестрикции. С помощью рентгеноструктурного анализа показано, что после взаимодействия Мтазы со специфическим участком ДНК остаток модифицируемого цитозина выпячивается из двойной спирали и образует ковалентную связь с полипептидной цепью фермента в положении С6. В этом промежуточном комплексе активированный атом углерода С5 акцептирует метильную группу S-аденозилметионина, выступающего в качестве кофактора.
Полипептидные цепи Мтаз эукариот содержат на своих N-концах большой домен, который обеспечивает ядерную локализацию ферментов, их доставку к репликативным вилкам, ответ ферментов на регуляторные воздействия.
Большинство прокариотических Мтаз способны метилировать ДНК de novo, распознавая неметилированные палиндромные гексануклеотидные последовательности. Они также метилируют последовательности, в которых одна цепь ДНК уже содержит метильные группы. В отличие от этого эукариотические Мтазы относятся к "поддерживающим" ферментам, которые узнают и метилируют только наполовину метилированные последовательности, формирующиеся во время репликации ДНК, когда вновь синтезированная цепь неметилирована. У млекопитающих остатки С метилируются преимущественно в составе динуклеотидов CpG, однако в последнее время описаны случаи метилирования и последовательностей CpNpG. В геноме позвоночных животных метилировано около 70% динуклеотидов CpG и около 6-7% всех остатков цитозина.
"Поддерживающие" Мтазы животных обладают небольшой способностью осуществлять метилирование ДНК и de novo в полностью неметилированных участках, а также искусственных субстратов (олигонуклеотидов), содержащих ошибочно спаренные основания. Остается непонятным, является ли указанное свойство Мтаз достаточным для осуществления метилирования de novo обширных участков генома в эмбриогенезе или же этот процесс происходит с участием других ферментов. Известно, что гомозиготные делеции в гене Мтазы у мышей вызывают гибель зародышей в раннем эмбриогенезе, что указывает на важную роль метилирования ДНК в онтогенезе млекопитающих. Однако даже у таких мутантных эмбрионов небольшая часть последовательностей ДНК метилирована. Метилирование остатков цитозина оказывает влияние на структурные характеристики ДНК. Это проявляется в облегчении перехода метилированных участков ДНК из B-формы в Z-форму, увеличении шага спирали ДНК и изменении кинетики образования крестообразных структур. Метильная группа 5-mC выступает на поверхности большой бороздки ДНК, находящейся в B-форме, и увеличивает ее гидрофобность, что в ряде случаев является решающим фактором при взаимодействии белков с соответствующими участками ДНК. В настоящее время у млекопитающих известны четыре ДНК-метилтрансферазы: Dnmtl, Dnmt2, Dnmt3a и Dnmt3b . Относительно природы ДНК-метилтрансферазы, осуществляющей метилирование de novo, существуют разные мнения. Возможно, это кодируемая геном DNMT1 ДНК-метилтрансфераза 1, ответственная за превалирующую в клетках млекопитающих метилтрансферазную активность и за поддерживающее метилирование (см. Рис.1).
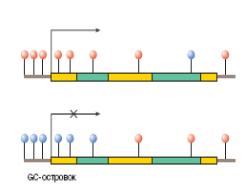
Рис.1. Профиль метилирования по длине гена. Стрелка показывает направление транскрипции гена, перечёркнутая крестиком стрелка указывает на инактивацию метилированного гена. Красные кружки обозначают цитозин, синие – 5-метил-цитозин. Жёлтыми прямоугольниками обозначены экзоны гена, зелёными – интроны [1].
