
- •Технологические энергоносители предприятий
- •1. Параметры состояния рабочего тела
- •1.1. Основные параметры состояния
- •1 Ат (техническая атмосфера) ≈ 98000 Па,
- •1.2 Внутренняя энергия
- •1.3. Энтальпия
- •1.4. Энтропия
- •Энергообеспечение предприятий
- •1. Общие термины.
- •2. Пассивная экономия энергии.
- •3. Активная экономия энергии применительно к действующим энергетическим и энергопотребляющим установкам.
- •5. Экономия энергии, достигаемая в результате организационных изменений и внедрения новых систем.
- •2 Теплотехнические и экономические основы производства и распределения энергоносителей
- •2.Системы воздухоснабжения предприятий.
- •2.1. Обеспечение предприятий сжатым воздухом
- •2.3.1. Определение нагрузок на компрессорную станцию
- •2.3.1.1 Укрупненный или метод определения нагрузок на компрессорную станцию
- •2.3.1.2 Расчетный метод определения нагрузок на кс
- •2.4 Выбор типоразмера и количества компрессоров устанавливаемых на компрессорной станции
- •2.5.2 Осевые компрессоры
- •2.7 Осушка воздуха
- •2.7.1 Способы осушки воздуха
- •2.7.2 Оптимальная точка росы
- •Системы охлаждения воздуха и характеристика теплообменной аппаратуры
- •Хладоснабжение предприятий
- •Дросселирование
- •Адиабатическое расширение с отдачей внешней работы
- •Сопоставление αs и αh
- •11.1 Угольное хозяйство.
- •11.2 Мазутное хозяйство
- •11.3 Газовое хозяйство
1.2 Внутренняя энергия
В технической термодинамике внутреннюю энергию обычно рассматривают как сумму двух слагаемых:
- внутренней кинетической энергии — суммарной кинетической энергии всех частиц, образующих систему;
- внутренней потенциальной энергии — потенциальной энергией, обусловленной силами взаимодействия между этими частицами (рис. 1.2).

Рис. 1.2. К определению понятия внутренней энергии
Принято обозначать внутреннюю энергию всей системы U, а отнесённую к единице массы — u . В первом случае она измеряется в Дж (джоулях), во втором — в Дж/кг.
Кинетическая энергия частиц пропорциональна температуре системы, а потенциальная энергия их взаимодействия зависит от расстояния между ними, т. е. от удельного объёма системы. Таким образом, в общем случае
u = u (T, υ) , (1.15)
то есть, внутренняя энергия однозначно определяется двумя основными параметрами состояния, и поэтому является тоже параметром состояния.
Поскольку в идеальном газе отсутствуют силы межмолекулярного взаимодействия, постольку его внутренняя энергия состоит лишь из кинети- ческой энергии составляющих частиц, т. е. она однозначно определяется только температурой газа:
u = u (T) . (1.15а)
1.3. Энтальпия
Энтальпия (теплосодержание, тепловая функция) всей системы обозначается Н и измеряется в джоулях (Дж), а отнесенная к единице массы обозначается h и измеряется в Дж/кг. Как и внутренняя энергия, энтальпия является параметром состояния, т. к. однозначно определяется другими параметрами состояния:
h = u + рυ. (1.16)
Отсюда
dh =du +d (рυ) (1.17)
Умножая обе части равенства (1.16) на массу всей системы m, получим выражение для определения энтальпии всей систёмы:
Н = U +рV,
Энтальпия – функция состояния термодинамической системы равная сумме ее внутренней энергии и произведения давления на объем системы.
1.4. Энтропия
Энтропия — параметр состояния (S), определяемый тем, что его дифференциал (dS) равен отношению бесконечно малого количества теплоты (dQ), участвующего в процессе, к абсолютной температуре, при которой эта теплота подводилась или отводилась:
для всей системы dS = dQ/Т, (1.18)
для 1 кг массы ds = dq/Т. (1.19)
В первом случае размерность Дж/К, а во втором — Дж(кг·К).
Если система адиабатна, т. е. не получает и не отдаёт теплоту (dq=0,
dQ =0) то, как следует из формул (1.18) и (1.19), её энтропия не меняется ds= dS =0. Иначе говоря, энтропия такой системы постоянна (S=const и s=const). В теплотехнических расчётах внутренняя энергия, энтропия и энтальпия принимаются равными нулю при нормальных физических условиях.
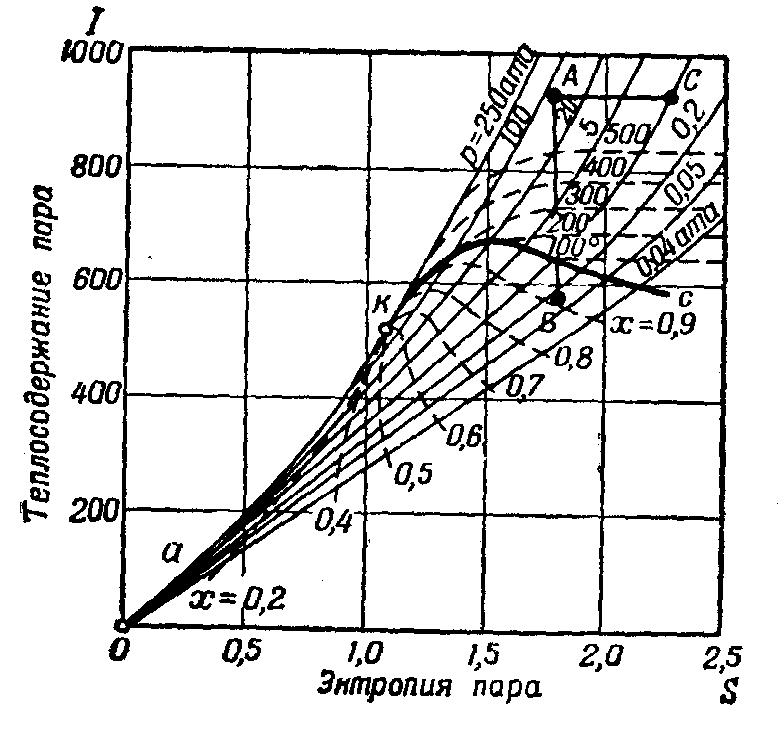
ЭНТРОПИЙНАЯ ДИАГРАММА — диаграмма, у к-рой по горизонтальной оси откладывается энтропия S, а по вертикальной — абсолютная т-ра Т (Т- S -диаграмма) или же теплосодержание I (I- S диаграмма). Э. д. облегчает теплотехнические расчеты. Наиболее часто применяется I- S диаграмма для водяного пара. На диаграмме проведены линии постоянных температур (изотермы), давлений (изобары), удельных объемов и паросодержания. Процесс адиабатического расширения пара (без сообщения и потерь тепла) изображается в I- S диаграмме вертикальной линией (АВ), проведенной из точки, соответствующей начальным параметрам пара, до пересечения с изобарой конечного давления пара. Процесс дросселирования изображается горизонтальной линией АС, проведенной из точки, соответствующей состоянию пара с начальными параметрами, до пересечения с изобарой конечного давления. Путем несложных построений можно найти конечные параметры пара для того или иного процесса
ЛЕКЦИЯ 3
(Сл24…31)
