
- •Использование ионного обмена для очистки воды от ионных загрязнений
- •Три составные части ионита и их условное обозначение на письме
- •Классификация ионитов
- •Количественные характеристики ионитов
- •Ионообменный аппарат смешанного действия
- •Волокнистые ионообменные материалы Промышленные фильтры, снаряженные волокнистыми ионообменными материалами, для очистки воздуха от кислых и щелочных газообразных примесей
- •Характеристики промышленных фильтров хвф с материалом вион.
Ионный обмен. 20.02.11.
Использование ионного обмена для очистки воды от ионных загрязнений
Ионный обмен: при фильтрации водного раствора через слой нерастворимых зерен ионита происходит обмен вредных катионов и анионов, содержащихся в воде, на безвредные катионы и анионы, содержащиеся в составе ионита.
Методом ионного обмена получают воду различной степени очистки: от обычной умягченной (например, с помощью бытового доочистителя питьевой воды) до продукта, равноценного дистилляту (в лаборатории).
Для простого умягчения воду фильтруют сначала через слой катионита в Н-форме (содержащиеся в воде катионы Са2+, Mg2+, Fe3+, Pb2+, Cu2+, Hg2+ и другие заменяются на катионы Н+ из катионита). Затем воду фильтруют через анионит в ОН-форме (содержащиеся в воде анионы Сl-, SO42-, СО32-, СN- и другие заменяются на анионы ОН- из анионита). После такой двухступенчатой обработки в очищенной воде остаются только гидросиликат-ионы HSiO3- (если они присутствовали в исходной воде), которые обычный ОН-анионит не поглощает. Потребуется еще сильноосновный анионит, содержащий в качестве активных групп основания с четвертичными аммонийными группами. Чистые вещества], стр. 71.
Три составные части ионита и их условное обозначение на письме
Эти составные части следующие:
1. Основная масса ионита, представляющая собой нерастворимые в воде золотистые зерна полимерного вещества с диаметром до 1мм, не включающая привитые к нему активные центры. Основная масса ионита без активных центров обозначается на письме знаком R-. Иногда для упрощения записи знаком R обозначают матрицу, включающую и нерастворимое зерно и привитые к нему активные центры).
2. Активные центры (ионогенные группы), химически прививаемые к поверхности зерен и связанные с ней ковалентными химическими связями. Например, активные группы
- SO3-, - СО2-, - РО32-, - N(CH3)3+.
3. Ионы, связанные с активными центрами ионными связями ( например, ионы Н+, Na+, OH- и т.п.) и способные к обмену на ионы, находящиеся в водном растворе.
Примеры условной записи химического состава ионитов:
R-SO3Н или R-Н (катионит, содержащий способные к обмену катионы водорода),
R-N(CH3)3ОН или RОН (анионит, содержащий способные к обмену гидроксид-ионы).
Классификация ионитов
1. Иониты классифицируют по виду обмениваемых ионов.
Катиониты (между катионитом и раствором обмениваются катионы)
Аниониты (между анионом и раствором обмениваются анионы)
Амфолиты (обмениваются и катионы и анионы).
2. Иониты классифицируют по способности к диссоциации.
Катиониты:
Сильнокислотные: обмениваются катионы сильных оснований при любых рН, а катионы слабых оснований при рН 7.
Слабокислотные: обмениваются катионы сильных оснований при рН 7 ( а катионы слабых оснований в растворах при рН 7 гидролизованы и к обмену, следовательно, не способны).
Аниониты:
Сильноосновные: обмениваются анионы сильных кислот при любых рН, а анионы слабых кислот при рН 7.
Слабоосновные: обмениваются анионы сильных кислот рН 7 (а анионы слабых кислот в растворах при рН 7 гидролизованы и к ионному обмену, следовательно, не способны).
Как более подробно на письме изображают катионит?
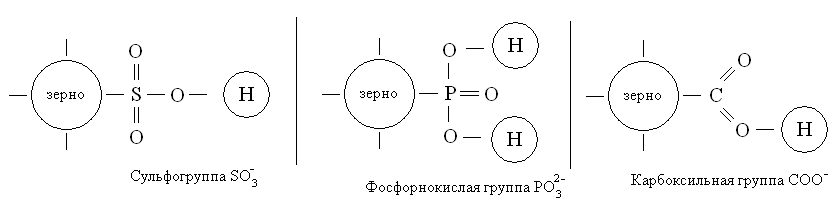
Рис.1. Три примера более подробного изображения катионита на письме. Слева большими кружками изображены зерна катионита, справа - привитые к зернам активные центры. В составе активных центров малыми кружками выделены катионы водорода, связанные сильнополярной связью (почти ионной) с атомами кислорода.
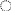 - О - Н . На рис.1 так
обозначена сильнополярная (почти ионная)
ковалентная химическая связь между
атомами кислорода и водорода.
- О - Н . На рис.1 так
обозначена сильнополярная (почти ионная)
ковалентная химическая связь между
атомами кислорода и водорода.
рН - lg Н+ или рН = - lg а(Н+),
где Н+ - молярная концентрация ионов водорода в воде, а(Н+) - активность ионов водорода.
а(Н+) = ∙ Н+, где - коэффициент активности (безразмерен), зависящий от ионной силы раствора и заряда иона. При концентрации Н+ 0 коэффициент активности 1.
Процессы ионного обмена подчиняются трем закономерностям
Эти закономерности следующие:
1. Эквивалентный обмен одних ионов на другие. Например, если катионит в Н-форме поглощает моль катионов Са2+ из раствора, то одновременно выделяет в раствор два моля катионов Н+.
2) Процесс обмена обратим. Равновесие в системе ионит - раствор описывается с помощью константы равновесия.
3) При ионном обмене происходит преимущественная «адсорбция» одних ионов по сравнению с другими (селективность).
Примеры уравнений процессов электролитической диссоциации ионитов:
![]() (1)
(1)
![]() (2)
(2)
Примеры уравнений реакций ионного обмена:
![]() (3)
(3)
![]() (4)
(4)
![]() (5)
(5)
![]() (6)
(6)
Запись
![]() означает, что представлено уравнение
обратимой
реакции,
протекающей в водном растворе (aq).
Запись Х(тв)
означает, что частицы Х
содержатся в твердой фазе (фазе ионита).
Запись Н+(в)
означает,
что гидратированные ионы водорода
находятся в водной среде.
означает, что представлено уравнение
обратимой
реакции,
протекающей в водном растворе (aq).
Запись Х(тв)
означает, что частицы Х
содержатся в твердой фазе (фазе ионита).
Запись Н+(в)
означает,
что гидратированные ионы водорода
находятся в водной среде.
Константа равновесия реакции ионного обмена
Для примера рассмотрим реакцию обмена катионов кальция из раствора на катионы водорода из катионита в Н-форме
![]() (7)
(7)
![]()

где а(Х) – активность ионов Х в водном растворе, моль/л раствора;
а(X) – активность ионов X в фазе ионита, моль/л. ионита.
Тепловой эффект реакции ионного обмена составляет 4 - 8 кДж/моль, т.е., он на порядки меньше, чем в случае обычных химических реакций (сотни кДж/моль). Поэтому константы равновесия реакций ионного обмена слабо изменяются с температурой.
Согласно правилу Ле-Шателье из уравнения реакции (7), в частности, следует, что при увеличении в растворе концентрации ионов Н+ ( при добавлении в раствор кислоты) равновесие реакции сдвигается влево.
Следовательно:
при увеличении в растворе концентрации ионов водорода эффективность ионного обмена снижается;
отработанный катионит можно восстановить (регенерировать), пропуская через него раствор кислоты.
Аналогично для реакции ионного обмена с участием анионита:
![]() (8)
(8)
 .
.
Как видно из уравнения (8), анионит можно регенерировать щелочью, возвращая его в ОН-форму при повышении в растворе концентрации ионов ОН-.
Селективность ионного обмена
Сродство неорганических катионов к сульфогруппам сильнокислотных катионитов увеличивается с уменьшением радиусов гидратированных катионов и с увеличением их зарядов. Проще – чем меньше радиус катиона и больше его электрический заряд, тем охотнее он вступает в реакцию ионного обмена. В соответствии с этой закономерностью катионы в порядкеувеличения их сродства к катиониту выстраиваются в следующий ряд:
Li+ < H+ < Na+ < NH4+ < K+ < Rb+ < Cs+ < Cu+ < Ag+ < Tl+ < Mg2+ < Zn2+
< Co2+ < Cu2+ < Cd2+ < Ni2+ < Ca2+ < Sr2+ < Pb2+ < Ba2+ < Al3+ < Ce4+ (9)
Источник: Руководство по хроматографии и смежным методам. Под ред. Микеш.Ч.1. М.: Мир, 1982, с.239.
Катионы, расположенные в ряду (9) справа, вытесняют из катионита катионы, расположенные слева. Или: катионы, расположенные в ряду (9) справа, имеют большее сродство к катиониту, чем катионы, расположенные слева.
Напомним, что в периодах и в подгруппах периодической системы элементов радиусы негидратированных катионов изменяются так: в периоде радиусы негидратированных катионов увеличиваются справа налево, а в подгруппах – сверху вниз. К сожалению не существует такой простой закономерности для гидратированных катионов.
Рассмотрим, как изменяется картина заполнения слоя катионита катионами при фильтрации через него водных растворов (рис.2).
Пусть в воде содержаться только катионы Na+, Mg2+ и Ca2+. При фильтрации воды через катионит в H – форме распределение катионов по слоям в катионите в начале, в середине и в конце цикла фильтрации имеет такой вид. [Копылов, с. 92].
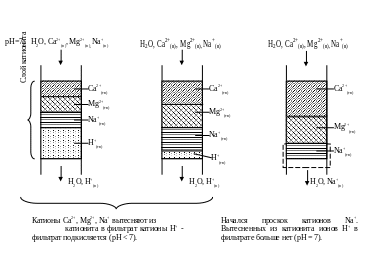
Рис.2. Три последовательные стадии постепенного заполнения слоя катионита катионами из раствора.
На рис.2 обозначение Ca2+(тв) означает, что катионы Ca2+ находятся в твердой фазе катионита. Аналогично трактуются обозначения Mg2+(тв), Na+(тв), H+(тв).
Как видно, в рассмотренном случае первыми в фильтрате появляются катионы Na+, затем к ним добавляются катионы Mg2+ и, наконец, катионы Ca2+. К этому моменту весь слой катионита оказывается заполненным катионами Ca2+, и катионит полностью перестает очищать воду.
Рассмотрим теперь сродство анионов к анионитам
Сродство анионов к сильно основным анионитам увеличивается с увеличением их поляризуемости. Поляризуемость (деформируемость внешних электронных оболочек атомов или молекулярных орбиталей молекул.) характеризуется коэффициентом поляризации α:
µ = α E,
где µ - вектор электрического дипольного момента атома или молекулы, имевший в отсутствие внешнего электрического поля нулевое значение; E – вектор напряженности внешнего электрического поля, B/м, вызывающего поляризацию.
Электрический дипольный момент можно определить также с помощью выражения
µ = q l, [ФЭС], с. 162
где l – расстояние между центрами положительных и отрицательных электрических зарядов q в атоме или молекуле (это вектор, направленный от центра отрицательных зарядов к центру положительных). Дипольный момент атома или молекулы является векторной величиной.
Приведем три ряда сродства анионов к анионитам, заимствованные из трех разных литературных источников:
CH3COO - < F - < HCOO - < CI - < SCN - < Br - < CrO42- < NO3- <
< I - < C2O42- < SO42 - < цитрат-ион*
OH - < HSiO3- < HCO3- < CI - < SO42-
OH - < F - < CI - < Br - < NO3- < HSO4- < I – (10)
Из рядов (10) следует, что при фильтрации воды через анионит в OH - форме первым в фильтрат попадают гидросиликат - ионы HSiO3- (если они есть в растворе).
* Цитрат-ион, это анион лимонной кислоты
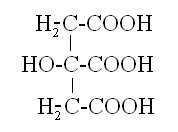
Общая закономерность
Ионы И1, расположенные в рядах (9) и (10) справа, вытесняют из ионита ионы И2, расположенные слева от И1.
Или иначе. Ионы И1, расположенные в рядах (9) и (10) справа, первыми вступают в реакции обмена и насыщают верхний слой ионита. Ионы И2, расположенные в рядах (9) и (10) левее, задерживаются в нижележащих, свободных от ионов И1, слоях ионита. По мере насыщения ионита ионы И1 вытесняют ионы И2, и последние появляются в фильтрате.
