
- •Оглавление
- •Предисловие
- •Введение
- •1.Основные понятия и законы геометической оптики
- •2. Волновой характер света.
- •2.1. Интерференция когерентных волн
- •2.1.1. Условия максимума и минимума интерференции когерентных волн
- •2.1.2. Интерференция при отражении света
- •2.1.3. Интерференция в тонком клине
- •2.1.4. Интерферометр Майкельсона
- •2.1.5. Интерференционные рефрактометры
- •2.2. Дифракция света
- •2.2.1. Принцип Гюйгенса-Френеля
- •2.2.2 Зоны Френеля
- •2.2.3 Дифракция Фраунгофера от щели.
- •2.2.4. Дифракционная решетка
- •2.2.5. Дифракция рентгеновских лучей
- •2.2.6. Голография
- •2.3. Поляризация света
- •2.3.1. Естественный и поляризованный свет
- •2.3.2. Способы получения поляризованного света
- •2.3.3 Закон Брюстера
- •2.3.4 Закон Малюса
- •2.3.5 Вращение плоскости поляризации
- •3. Взаимодействие электромагнитного излучения с веществом
- •3.1 Взаимодействие света с веществом
- •3.2. Классическая теория дисперсии
- •3.3 Тепловое излучение, его характеристика Абсолютно черное тело
- •3.4. Тепловое равновесие, закон Кирхгофа
- •3.5. Рассеяние света. Закон Рэлея
- •3.6 Поглощение света. Закон Бугера-Ламберта
- •4. Дуализм материи
- •4.1. Закономерности излучения абсолютно черного тела
- •4.2.Эффект Комптона
- •4.3 Фотоэлектрический эффект и природа электромагнитного излучения
- •4.4. Гипотеза де Бройля
- •4.5. Дифракция электронов. Опыт Дэвисона и Джермера
- •4.3. Соотношение неопределенностей
- •4.7. Волновая функция. Уравнение Шредингера
- •4.8. Электрон в «потенциальной яме» Квантование энергии
- •4.9.Теория атома водорода по Бору
- •4.9.1.Модель атома Резерфорда
- •4.9.2. Линейчатый спектр атома водорода
- •4.9.3. Строение атома. Постулаты Бора
- •4.9.4. Спектр атома водорода по Бору
- •4.9.5. Опыт Франка и Герца
- •5. Радиоактивные превращения
- •5.1. Состав атомного ядра, энергия связи ядра, законы радиоактивных превращений
- •5.2.Кинетика естественного радиоактивного распада
- •5.3. Ядерные реакции и их классификация
- •5.4.Управляемая реакция деления ядер
- •5.5. Использование ядерных превращений
- •5.5.1.Ядерная энергетика.
- •5.5.2. Атомная бомба
- •5.5.3. Реакция синтеза атомных ядер
- •Заключение
- •Библиографический список
- •О волновой и квантовой концепциях оптики
- •305040, Г. Курск, ул. 50 лет Октября, 94.
4.9.2. Линейчатый спектр атома водорода
На самом деле многие атомы представляют собой устойчивые структуры, существующие десятки тысяч лет без изменения. А исследования спектров излучения отдельных атомов (спектров разреженных газов) показали, что каждому газу присущ вполне определённый линейчатый спектр.
Самым изученным является спектр атома водорода. Швейцарский учёный И. Бальмер (1825 – 1898) подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
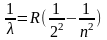 или
(т.к.
или
(т.к.
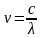 )
)
 ,
,
где n = 3,4,5…,
R = 1,1·10-7м-1 – постоянная Ридберга.
Из этих выражений вытекает, что спектральные линии, отличающиеся различными значениями n, образуют группу или серию линий, называемую серией Бальмера. С ростом n линии серии сближаются, значение n = ∞ определяет границу серии, к которой со стороны больших частот примыкает сплошной спектр.
В начале 20 века в спектре атома водорода было обнаружено ещё несколько серий. В ультрафиолетовой области спектра находится серия Лаймана:
 ,
n
= 2, 3,4,…
,
n
= 2, 3,4,…
В инфракрасной области спектра были также обнаружены:
серия
Пашена:
 ,
где n
= 4,5,6…;
,
где n
= 4,5,6…;
Брэкета:
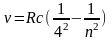 ,
где n
=5,6,7…;
,
где n
=5,6,7…;
Пфунда:
 ,
где n
= 6,7,8…;
,
где n
= 6,7,8…;
Хэмфри:
 ,
где n
= 7,8,9….
,
где n
= 7,8,9….
Все приведённые выше серии в спектре атома водорода описывают обобщённой формулой Бальмера:
 ,
(5.1)
,
(5.1)
где k = 1,2,3,4,5,6. значение k определяет серию,
n = k+1, k+2, k+3… - определяет отдельные линии этой серии.
(здесь k – основной уровень, n – возбуждённый)
(5.1) – были подобраны эмпирически и долгое время не имели практического обоснования.
4.9.3. Строение атома. Постулаты Бора
Идея Бора – связать в единое целое эмпирические закономерности линейчатых спектров, ядерную (или планетарную) модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил два постулата.
1 постулат – 1913г. (постулат стационарных состояний):
В атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он, не излучает энергию. Этим состояниям соответствуют стационарные орбиты, по которым движутся электроны, не излучая при этом. Возможен лишь дискретный ряд орбит, по которым электрон может двигаться в стационарном состоянии. При этом он имеет дискретные (квантованные) значения момента импульса, удовлетворяющие условию:
me·vn·rn = nħ, (n = 1,2,3…)
me – масса электрона;
vn – его скорость на n-ой орбите;
rn - радиус n – ой орбиты;
ħ = h/2π – постоянная Планка.
2 постулат Бора:
При переходе электрона с одной орбиты на другую излучается (или поглощается) один фотон с энергией hν равной разности энергий соответствующих стационарных состояний:
hν = Еn – Еk,
Еn и Еk – соответственно энергии стационарных состояний атома до и после излучения или поглощения.
При Еn >Еk происходит излучение фотона, т.е. атом переходит из состояния с большей энергией в состояние с меньшей энергией (переход электрона с более удалённой от ядра орбиты на более близлежащую).
При Еn < Еk фотон поглощается при переходе электрона на более удалённую от ядра орбиту, атом переходит в состояние с большей энергией.
Набор
возможных дискретных частот
 квантовых переходов определяет линейчатый
спектр атома.
квантовых переходов определяет линейчатый
спектр атома.
