
- •Оглавление
- •Предисловие
- •Введение
- •1.Основные понятия и законы геометической оптики
- •2. Волновой характер света.
- •2.1. Интерференция когерентных волн
- •2.1.1. Условия максимума и минимума интерференции когерентных волн
- •2.1.2. Интерференция при отражении света
- •2.1.3. Интерференция в тонком клине
- •2.1.4. Интерферометр Майкельсона
- •2.1.5. Интерференционные рефрактометры
- •2.2. Дифракция света
- •2.2.1. Принцип Гюйгенса-Френеля
- •2.2.2 Зоны Френеля
- •2.2.3 Дифракция Фраунгофера от щели.
- •2.2.4. Дифракционная решетка
- •2.2.5. Дифракция рентгеновских лучей
- •2.2.6. Голография
- •2.3. Поляризация света
- •2.3.1. Естественный и поляризованный свет
- •2.3.2. Способы получения поляризованного света
- •2.3.3 Закон Брюстера
- •2.3.4 Закон Малюса
- •2.3.5 Вращение плоскости поляризации
- •3. Взаимодействие электромагнитного излучения с веществом
- •3.1 Взаимодействие света с веществом
- •3.2. Классическая теория дисперсии
- •3.3 Тепловое излучение, его характеристика Абсолютно черное тело
- •3.4. Тепловое равновесие, закон Кирхгофа
- •3.5. Рассеяние света. Закон Рэлея
- •3.6 Поглощение света. Закон Бугера-Ламберта
- •4. Дуализм материи
- •4.1. Закономерности излучения абсолютно черного тела
- •4.2.Эффект Комптона
- •4.3 Фотоэлектрический эффект и природа электромагнитного излучения
- •4.4. Гипотеза де Бройля
- •4.5. Дифракция электронов. Опыт Дэвисона и Джермера
- •4.3. Соотношение неопределенностей
- •4.7. Волновая функция. Уравнение Шредингера
- •4.8. Электрон в «потенциальной яме» Квантование энергии
- •4.9.Теория атома водорода по Бору
- •4.9.1.Модель атома Резерфорда
- •4.9.2. Линейчатый спектр атома водорода
- •4.9.3. Строение атома. Постулаты Бора
- •4.9.4. Спектр атома водорода по Бору
- •4.9.5. Опыт Франка и Герца
- •5. Радиоактивные превращения
- •5.1. Состав атомного ядра, энергия связи ядра, законы радиоактивных превращений
- •5.2.Кинетика естественного радиоактивного распада
- •5.3. Ядерные реакции и их классификация
- •5.4.Управляемая реакция деления ядер
- •5.5. Использование ядерных превращений
- •5.5.1.Ядерная энергетика.
- •5.5.2. Атомная бомба
- •5.5.3. Реакция синтеза атомных ядер
- •Заключение
- •Библиографический список
- •О волновой и квантовой концепциях оптики
- •305040, Г. Курск, ул. 50 лет Октября, 94.
4.8. Электрон в «потенциальной яме» Квантование энергии
Уравнение Шредингера позволяет решать практические задачи и находить состояния движения частиц в различных внешних полях.
Э лектрические
свойства металлов объясняются наличием
в них свободных электронов. Результирующая
сила, действующая на электрон со стороны
ионов и всех остальных электронов, в
среднем равна нулю. Следовательно,
потенциальная энергия ЕП
электрона внутри металла постоянна и
ее можно выбрать за начало отсчета и
считать равной 0.
лектрические
свойства металлов объясняются наличием
в них свободных электронов. Результирующая
сила, действующая на электрон со стороны
ионов и всех остальных электронов, в
среднем равна нулю. Следовательно,
потенциальная энергия ЕП
электрона внутри металла постоянна и
ее можно выбрать за начало отсчета и
считать равной 0.
На границах металла расположен двойной электрический слой, для преодоления которого нужно затратить работу выхода АВЫХ. Поэтому потенциальная энергия электрона вне металла ЕП= АВЫХ > 0.
Направим ось х перпендикулярно к грани бруска металла длиной l . Потенциальная энергия Еп показана на рис.4.2.
Уравнение Шредингера в рассматриваемом случае имеет вид:
 ,
(т.к Еп=0) (4.10)
,
(т.к Еп=0) (4.10)
Решением этого однородного дифференциального уравнения 2-го порядка является функция:
 (4.11)
(4.11)
где
k
=
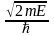 ,
а С1
и С2
- постоянные, определяемые из граничных
условий и условия нормировки.
,
а С1
и С2
- постоянные, определяемые из граничных
условий и условия нормировки.
Пока
кинетическая энергия электрона мала
по сравнению с высотой стенок «потенциальной
ямы»
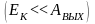 электрон не имеет возможность выйти за
пределы потенциальной ямы, поэтому
граничные условия состоят в следующем:
электрон не имеет возможность выйти за
пределы потенциальной ямы, поэтому
граничные условия состоят в следующем:
 (4.12)
(4.12)
 (4.13)
(4.13)
Условие (4.12) после подстановки в (4.11) дает С2 = 0, а условие (4.13) приводит к выражению sin kl = 0, из которого следует:
kl = nπ, где n =1, 2, 3… (4.14)
П ри
этом учтено, что С1
0,
т.к. электрон находится внутри ямы –
это достоверно и что k
0
в силу того, что электрон движется.
Запишем выражение (4.14) в развернутом
виде:
ри
этом учтено, что С1
0,
т.к. электрон находится внутри ямы –
это достоверно и что k
0
в силу того, что электрон движется.
Запишем выражение (4.14) в развернутом
виде:
 .
.
Откуда следует, что энергия электрона может иметь только дискретные значения Е(n):
 (4.15)
(4.15)
На рис.4.3 дана схема разрешенных энергетических уравнений. Числа n называются «квантовыми» числами.
Заметим, что квантование энергии частиц впервые ввел Н.Бор ещё до создания квантовой механики.
4.9.Теория атома водорода по Бору
4.9.1.Модель атома Резерфорда
Первым научным представлением о строении атома была томсоновская модель: «размазанный» положительный заряд, в котором плавают электроны.
В 1911 году английский физик Резерфорд на основании своих исследований предложил планетарную модель атома:
Вокруг положительного ядра, имеющего заряд Z∙e (где Z – порядковый номер элемента в системе Менделеева, e – элементарный заряд), размер которого 10-15 – 10-14 м и массу, практически равную массе атома, в области с линейными размерами ~10-10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Т.к. атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т.е. вокруг ядра вращается Z электронов.
На основании второго закона Ньютона для электрона, движущегося по окружности под действием кулоновской силы:
 .
.
Здесь r и v - неизвестные величины. Существует бесчисленное множество значений радиуса и соответствующих ему значений скорости (а значит и энергии Е), удовлетворяющих этому уравнению. Поэтому величины r и v (следовательно и Е) могут меняться непрерывно, т.е может испускаться любая энергия. Тогда спектры атомов должны быть сплошными. (Однако, в действительности, атомы имеют линейчатые спектры.) Кроме того, по законам электродинамики движущийся вокруг ядра с центростремительным ускорением электрон излучает электромагнитные волны и, непрерывно теряя энергию, должен «упасть» на ядро. Атом по Резерфорду получился неустойчивой системой.
