
- •Растворы электролитов. Теория электрической диссоциации.
- •Сильные электролиты.
- •Механизм движения ионов. Абсолютная скорость ионов.
- •Удельная электропроводность растворов. Эквивалентная электропроводность растворов.
- •Электродные процессы. Двойной электрический слой.
- •Гэ и цепи.
- •Электродные потенциалы. Водородный электрод. Ряд напряжений металлов.
- •Классификация электродов.
- •Классификация гэ.
- •Зависимость напряжения гэ от температуры. Метод эдс.
- •Кинетика гомогенных реакций. Закон действующих масс. Кинетическое уравнение первого порядка. Период полураспада.
- •Кинетика гомогенных реакций. Закон действующих масс. Кинетическое уравнение второго порядка. Период полураспада.
- •13)Методы определения порядка реакции.
- •14)Последовательные реакции.
- •15)Параллельные реакции.
- •16) Зависимость скорости реакции от температуры. Уравнение Аррениуса. Энергия активации.
- •Растворы электролитов. Теория электрической диссоциации.
- •Сильные электролиты.
Растворы электролитов. Теория электрической диссоциации.
Электролиты – вещества, которые в растворе или расплаве полностью или частично состоят из ионов. Данные вещества способны проводить электрический ток.
Теория
Аринуса:1)При
растворении в воде молекулы электролитов
распадаются на катионы и анионы, что
приводит изменению энергии Гиббса.
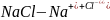 .
2)Процесс диссоциации обратим, т.е. в
растворе существует равновесие. А при
разбавлении возможна полная диссоциация.
.
2)Процесс диссоциации обратим, т.е. в
растворе существует равновесие. А при
разбавлении возможна полная диссоциация.
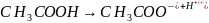 . 3)Сумма катионов равна сумме анионов.
4)Растворы ведут себя, как идеальные
газы (истинно только для растворов
слабых электролитов).
. 3)Сумма катионов равна сумме анионов.
4)Растворы ведут себя, как идеальные
газы (истинно только для растворов
слабых электролитов).
Для
количественной характеристики
электролитов была введена степень
диссоциации:
 - число продиссоциированных молекул;
- число продиссоциированных молекул; - общее число молекул в растворе; По
степени диссоциации различают сильные
(
- общее число молекул в растворе; По
степени диссоциации различают сильные
(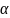 =1, диссоциация проходит полностью) и
слабые (
=1, диссоциация проходит полностью) и
слабые ( электролиты.
электролиты.
Характеристикой слабых электролитов является константа диссоциации:
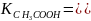 Связь
между
Связь
между
 и
описывает закон разбавления Осфальда:
и
описывает закон разбавления Осфальда:
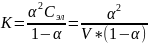 . Растворы электролитов значительно
отличаются от идеальных растворов тем,
что происходит увеличение частиц в
результате диссоциации.
. Растворы электролитов значительно
отличаются от идеальных растворов тем,
что происходит увеличение частиц в
результате диссоциации.
Изотонический
коэффициент
– отношение фактического числа частиц
в растворе, к тому, которое было бы без
диссоциации.
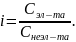 Связь
между
Связь
между
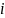 и
:
и
:
 K
– суммарное число ионов, образующихся
в процессе диссоциации 1 молекулы
электролита.
K
– суммарное число ионов, образующихся
в процессе диссоциации 1 молекулы
электролита.
Сильные электролиты.
В растворах полностью диссоциируют на ионы;
Между ионами существует электростатическое взаимодействие – каждый ион окружён обратно заряженными ионами, так называемой ионной атмосферой.
Для растворов сильных электролитов используют активности, а не концентрации.
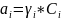
Коэффициент
активности
(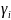 )
– мера отличия свойств растворов
электролитов от свойств идеальных
растворов.
)
– мера отличия свойств растворов
электролитов от свойств идеальных
растворов.
Для
сильных электролитов нужно учитывать
силы электростатического взаимодействия
между ионами, т.к. происходит уменьшение
скорости движения ионов из-за двух
эффектов: 1)Катоффетический
– торможение ионов при движении из-за
наличия ионной атмосферы. 2)Релаксационный
– разрушение старой ионной атмосферы
и образование новой.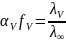
Механизм движения ионов. Абсолютная скорость ионов.
Для включения электрического поля ионы хаотично движутся,а при наложении поля одно из направлений преобладает,и движение от А к К.По мере увеличения скор.движения возрастает сопротивление среды,оно больше,чем больше вязкость среды и радиус иона.Абсолютная скорость движения ионов равна скорости движения иона при напряжённости электрич.поля = 1 вольт/м2.По мере уменьш. концентрации возрастает число ионов в р-ре.
Движение ионов возникает из-за: 1) неодинакового распределения ионов по обе стороны мембраны; 2) избирательной проницаемости мембраны для ионов. В состоянии покоя мембрана неодинаково проницаема для различных ионов.
Удельная электропроводность растворов. Эквивалентная электропроводность растворов.
Проводники
электрического тока делятся: 1)Проводники
1-го рода (металлы):
ток переносится путём направленного
движения электронов. Движение тока не
приводит к химическим изменениям.
2)Проводники
2-го рода ( твёрдые соли, концентрированные
расплавы и растворы электролитов):
при повышении температуры возрастает
проводимость, т.к. уменьшается процесс
гидратации ионов и вязкость среды.
Примем движение ионов, за движение
шариков в вязкой среде. На них действует
сила среды, пропорциональная силе поля:
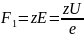 .
При увеличении скорости, увеличивается
сопротивление среды:
.
При увеличении скорости, увеличивается
сопротивление среды:
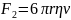 ,
,
 ,
,
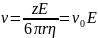 ,
V
– скорость иона,
,
V
– скорость иона,
 - абсолютная скорость движения иона.
- абсолютная скорость движения иона.
Количественной
способностью проводника проводить
электрический ток, является удельная
электропроводимость
()
– электропроводимость объёма электролита,
помещённого между электродами (S=1см2
) на расстоянии 1 см:
 Зависит
от:1)Природы
электролита;2)Концентрации ионов
электролита;3)Скорости движения;4)Вязкости
среды;5)Величины диэлектрической
постоянной растворителя;6)Температуры.
Зависит
от:1)Природы
электролита;2)Концентрации ионов
электролита;3)Скорости движения;4)Вязкости
среды;5)Величины диэлектрической
постоянной растворителя;6)Температуры.
