- •Лабораторная работа № 1 (4 ч.)
- •Теоретическая часть
- •Формулы и названия основных кислот.
- •Экспериментальная часть
- •Порядок выполнения работы
- •2. Получение и свойства гидроксидов
- •3. Получение солей.
- •Контрольные задания:
- •Групповые реакции катионов и анионов.
- •Экспериментальная часть
- •Образец записи в лабораторный журнал
- •Реакция на po ион
- •Реакция на Cl- ион
- •Реакция на ch3coo- ион
- •Реакция на no ион
- •Реакция на j- ион
- •Реакция на c2o ион
- •Качественные реакции на катионы
- •Реакция на ион nh
- •Контрольные вопросы
- •Теоретическая часть
- •Классификация воды по уровню жёсткости
- •Экспериментальная часть
- •Порядок выполнения работы:
- •1. Гидролиз карбонатов
- •2. Действие кислот на карбонаты и гидрокарбонаты.
- •3. Устранение временной (карбонатной ) жесткости.
- •4. Устранение постоянной жесткости.
- •Лабораторная работа №4 (4 ч.) учение о составе – первый уровень в познании свойств веществ
- •Опыт № 1 доктор, который всегда под рукой
- •Опыт № 2 как различить шерсть и хлопок?
- •Опыт № 3 странная жидкость
- •Опыт № 4 гипосульфит натрия – внештатный сотрудник химчистки
- •Опыт № 5 влияние кислотности среды или марганцовка в роли хамелеона
- •Лабораторная работа №5 (4 ч.) структурная химия - второй уровень познания свойств веществ
- •Опыт № 1 как обнаружить фруктозу в меде, ягодах и фруктах?
- •Опыт № 2 до синей окраски, если не нагревать
- •Опыт № 3 денатурация белковых молекул – польза или вред?
- •Часть 1 осаждение белков хлоридом натрия
- •Часть 2 осаждение белков солями тяжелых металлов
- •Лабораторная работа №6 (4 ч.) учение о химических процессах – третий уровень познания свойств веществ
- •Опыт № 1 влияние концентрации веществ на химическое равновесие
- •Часть 1
- •Часть 2
- •Опыт № 2 изучение скорости взаимодействия тиосульфата натрия и серной кислоты
- •Опыт № 3 влияние катализатора на скорость реакции разложения пероксида водорода
- •3. Список используемой литературы
- •5. Приложения
Опыт № 2 до синей окраски, если не нагревать
Предварительные сведения. Коллоидный раствор крахмала после добавления в него раствора йода синеет. Йодную пробу используют для качественного обнаружения крахмала. Крахмал - самый распространенный запасной углевод растений. Крахмал относится к классу полисахаридов и состоит из двух основных фракций – амилозы (линейная) и амилопектина (разветвленная).
Амилоза представляет собой длинную линейную цепь остатков циклических молекул глюкозы, соединенных через атомы кислорода. Полимерные цепи амилозы в пространстве образуют спирали. Молекулы йода внедряются во внутренний канал этой спирали и образуют комплексы синего цвета (соединения включения). При нагревании комплексные соединения разрушаются, и следствием этого является обесцвечивание раствора. При охлаждении идет обратный процесс.
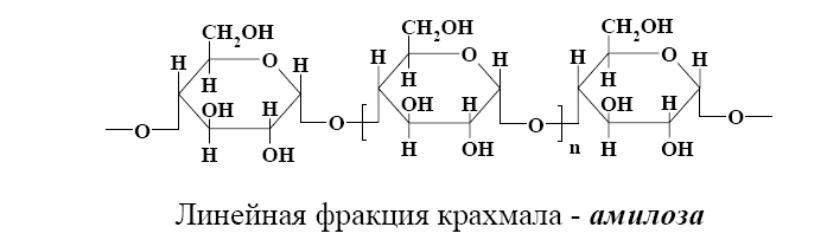
Амилопектин состоит из тех же самых остатков циклических молекул глюкозы, но имеет разветвленное строение. Внешне амилопектин напоминает глобулу (шар).
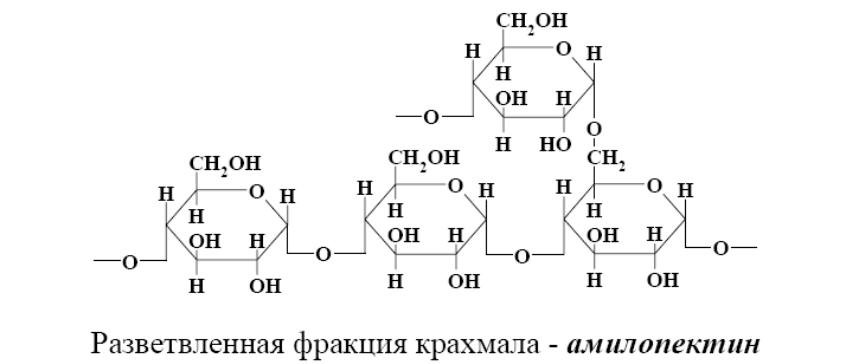
Соотношение амилозы и амилопектина в крахмале зависит от вида растения. В среднем, в крахмале содержится 25% амилозы и 75% амилопектина. Важнейшим свойством крахмала является гидролиз.
Порядок выполнения:
Добавьте 1 каплю йодной настойки к 10 мл воды (раствор слабо-желтый). Это индикатор для обнаружения крахмала.
Налейте в две другие пробирки по 1 мл раствора крахмала и добавьте в каждую пробирку по две капли приготовленного Вами раствора йода.
Нагрейте одну из пробирок на водяной бане. Вторую оставьте в штативе (пробирка сравнения).
Охладите нагретую пробирку холодной водой из-под крана.
Наблюдения:
1 Как меняется цвет раствора крахмала в пробирке при добавлении раствора йода?
2. Как изменился цвет раствора при нагревании и последующем охла-ждении?
Выводы:
1. Объясните, почему раствор картофельного крахмала дает синее ок-рашивание при взаимодействии с йодом.
2. Объясните, почему при нагревании эта окраска исчезает.
3. Почему коллоидный раствор рисового крахмала не дает синего ок-рашивания при взаимодействии с йодом?
4. Почему из клетчатки (целлюлозы) получают волокно, а из крахмала нет?
Опыт № 3 денатурация белковых молекул – польза или вред?
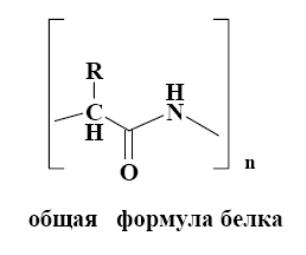
Предварительные сведения. Белки – это природные полимеры, построенные из остатков α – аминокислот.
|
Важным свойством белков является их способность к осаждению. Обратимое осаждение называют высаливанием, а необратимое осаждение – денатурацией. Денатурация – процесс необратимого разрушения пространственной структуры белка, при котором нарушается четвертичная, третичная, а в ряде случаев и вторичная структуры белка. |
Денатурацию вызывают: нагрев, УФ-облучение, ионизирующая радиация, ультразвук, действие сильных кислот и щелочей, солей тяжелых металлов.
Белки под влиянием перечисленных факторов теряют свои природные свойства и активность. Внешне это выражается в свертывании и выпадении их в осадок. С химической точки зрения разрываются водородные связи, разрушаются дисульфидные и солевые мостики, но сама полипептидная цепь не разрушается, первичная структура сохраняется.
Денатурация белков обычно сопровождается понижением их растворимости, увеличением вязкости и потерей биологической активности. Все пищевые продукты, обработанные с применением высоких температур, содержат денатурированный белок (тепловая денатурация). Денатурированный белок легче переваривается и дольше хранится.
Важное значение имеет денатурация под действием кислот, примером которой служит скисание молока.
Денатурация может проходить также под влиянием солей тяжелых металлов, однако она, как правило, играет отрицательную роль: способствует дезактивации ферментов, и особенно белков, содержащих серу.