- •Лабораторная работа № 1 (4 ч.)
- •Теоретическая часть
- •Формулы и названия основных кислот.
- •Экспериментальная часть
- •Порядок выполнения работы
- •2. Получение и свойства гидроксидов
- •3. Получение солей.
- •Контрольные задания:
- •Групповые реакции катионов и анионов.
- •Экспериментальная часть
- •Образец записи в лабораторный журнал
- •Реакция на po ион
- •Реакция на Cl- ион
- •Реакция на ch3coo- ион
- •Реакция на no ион
- •Реакция на j- ион
- •Реакция на c2o ион
- •Качественные реакции на катионы
- •Реакция на ион nh
- •Контрольные вопросы
- •Теоретическая часть
- •Классификация воды по уровню жёсткости
- •Экспериментальная часть
- •Порядок выполнения работы:
- •1. Гидролиз карбонатов
- •2. Действие кислот на карбонаты и гидрокарбонаты.
- •3. Устранение временной (карбонатной ) жесткости.
- •4. Устранение постоянной жесткости.
- •Лабораторная работа №4 (4 ч.) учение о составе – первый уровень в познании свойств веществ
- •Опыт № 1 доктор, который всегда под рукой
- •Опыт № 2 как различить шерсть и хлопок?
- •Опыт № 3 странная жидкость
- •Опыт № 4 гипосульфит натрия – внештатный сотрудник химчистки
- •Опыт № 5 влияние кислотности среды или марганцовка в роли хамелеона
- •Лабораторная работа №5 (4 ч.) структурная химия - второй уровень познания свойств веществ
- •Опыт № 1 как обнаружить фруктозу в меде, ягодах и фруктах?
- •Опыт № 2 до синей окраски, если не нагревать
- •Опыт № 3 денатурация белковых молекул – польза или вред?
- •Часть 1 осаждение белков хлоридом натрия
- •Часть 2 осаждение белков солями тяжелых металлов
- •Лабораторная работа №6 (4 ч.) учение о химических процессах – третий уровень познания свойств веществ
- •Опыт № 1 влияние концентрации веществ на химическое равновесие
- •Часть 1
- •Часть 2
- •Опыт № 2 изучение скорости взаимодействия тиосульфата натрия и серной кислоты
- •Опыт № 3 влияние катализатора на скорость реакции разложения пероксида водорода
- •3. Список используемой литературы
- •5. Приложения
Лабораторная работа № 1 (4 ч.)
Тема: Основные классы неорганических соединений
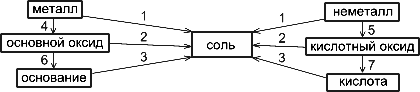
Цель: ознакомиться со свойствами и методами получения оксидов, кислот, солей, оснований, а также проследить генетическую связь между классами неорганических соединений.
Теоретическая часть
Неорганические вещества в зависимости от состава и свойств делятся на следующие основные классы:

Простые вещества состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения) состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород.
Классификация. Несолеобразующие (CO, N2O, NO) и солеобразующие.
Солеобразующие оксиды: основные (Na2O; MgO; CuO), амфотерные (ZnO; Al2O3; Cr2O3); SnO2) и кислотные (SO2; SO3; P2O5; Mn2O7; CrO3).
Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-).
Классификация. Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот.
Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка (с точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+).
Классификация. По составу: бескислородные и кислородсодержащие; по числу атомов водорода, способных замещаться на металл: одно-, двух-, трёхосновные.
Таблица 1
Формулы и названия основных кислот.
-
Бескислородные:
Основность
Название соли
HCl - хлористоводородная (соляная)
одноосновная
хлорид
HBr - бромистоводородная
одноосновная
бромид
HI - йодистоводородная
одноосновная
йодид
HF - фтористоводородная (плавиковая)
одноосновная
фторид
H2S - сероводородная
двухосновная
сульфид
Кислородсодержащие:
HNO3 – азотная
одноосновная
нитрат
H2SO3 - сернистая
двухосновная
сульфит
H2SO4 – серная
двухосновная
сульфат
H2CO3 - угольная
двухосновная
карбонат
H2SiO3 - кремниевая
двухосновная
силикат
H3PO4 - ортофосфорная
трёхосновная
ортофосфат
Соли – сложные вещества, которые состоят из атомов металла и кислотных остатков. Это наиболее многочисленный класс неорганических соединений.
Классификация. По составу и свойствам: средние, кислые, основные, двойные, смешанные, комплексные
Средние соли являются продуктами полного замещения атомов водорода многоосновной кислоты на атомы металла.
При диссоциации дают только катионы металла (или NH4+). Например:
Na2SO4
2Na+
+SO![]()
CaCl2 Ca2+ + 2Cl-
Кислые соли являются продуктами неполного замещения атомов водорода многоосновной кислоты на атомы металла.
При диссоциации дают катионы металла (NH4+), ионы водорода и анионы кислотного остатка, например:
NaHCO3
Na+
+
HCO![]()
H+
+CO
H+
+CO![]() .
.
Основные соли являются продуктами неполного замещения групп OH- соответствующего основания на кислотные остатки.
При диссоциации дают катионы металла, анионы гидроксила и кислотного остатка.
Zn(OH)Cl [Zn(OH)]+ + Cl- Zn2+ + OH- + Cl-.
Двойные соли содержат два катиона металла и при диссоциации дают два катиона и один анион.
KAl(SO4)2 K+ + Al3+ + 2SO
Комплексны соли содержат комплексные катионы или анионы.
[Ag(NH3)2]Br [Ag(NH3)2]+ + Br- Ag+ +2 NH3 + Br-
Na[Ag(CN)2] Na+ + [Ag(CN)2]- Na+ + Ag+ + 2 CN-
Генетическая связь между различными классами соединений