ПОЛИМЕРИЗАЦИЯ
Термодинамика полимеризации
G = H - TS + pV
G = -RT lnK
В случае полимеризации H отрицательна, процесс превращения С=С связи в С-С связь экзотермический. S – положительна, поскольку уменьшается число степеней свобод.
Если G = 0 то имеет место равновесие процессов полимеризации и деполимеризации.
В случае низкомолекулярных соединений энтропийным фактором можно пренебречь, поскольку S имеет порядок кал/мол К, в то время как Н – ккал/моль. В случае же полимеров, из-за того, что из многих (сотен) молекул получается одна суммарное изменение S оказывается сравнимым с Н, поскольку число степеней свободы падает как Nех, а тепловой эффект растет как Nх.
Из этого следует, что, в отличие от низкомолекулярных соединений, у полимеров имеется предельная температура полимеризации, определяемая как
![]()
Предельные температуры полимеризации
Мономер |
Предельная температура полимеризации |
Стирол |
310 |
Метилметакрилат |
220 |
Изобутилен |
-45 |
Однако полиизобутилен существует при комнатной температуре неопределенно долго, ЧТО СВЯЗАНО С КИНЕТИКОЙ РЕАКЦИИ ДЕПОЛИМЕРИЗАЦИИ. Внесение инициатора (кислоты) вызывает быструю и количественную деполимеризацию. Ситуация аналогична равновесию алмаз-графит.
Предельную температуру полимеризации можно увеличить, увеличивая давление. Например, изомасляный альдегид имеет предельную температуру полимеризации при нормальном давлении менее -273, однако полимеризуется при 5000 атм., причем полимер деполимеризуется при снятии давления.
Кинетика имеет иногда критично важное значение. Например, триблоксополимер – полипропилен-изомасляный альдегид – пропилен не деполимеризуется до 2000С, что является исключительно кинетическим эффектом.
Определение. Под полимеризацией понимают метод синтеза полимеров при котором количество реакционных центров (в идеальных условиях) остается постоянным в течении всего процесса.
По типу активного центра растущей полимерной цепи различают Радикальную, катионную, анионную, а также координационную полимеризацию.
РАДИКАЛЬНАЯ ПОЛИМЕРИЗАЦИЯ
Мономеры
С точки зрения органической химии – полимеризация суть реакция присоединения. Как известно, в реакции радикального присоединения наиболее активны соединения с кратными С=С связями
Соотношение активность радикала – активность мономера
Относительные константы присоединения к растущему радикалу соответствующих мономеров 600С
Мономер |
К присоединения /К обрыва |
Бутадиен |
0,004 |
Стирол |
0,022 |
Метилметакрилат |
0,11 |
Акрилонитрил |
0,12 |
винилхлорид |
0,24 |
Винилацетат |
0,30 |
этилен |
2,30 |
Отсюда чем лучше стабилизирован радикал, тем он менее активен и тем более активным является соответствующий ему мономер.
Электронные факторы
Статический фактор – индуктивный эффект
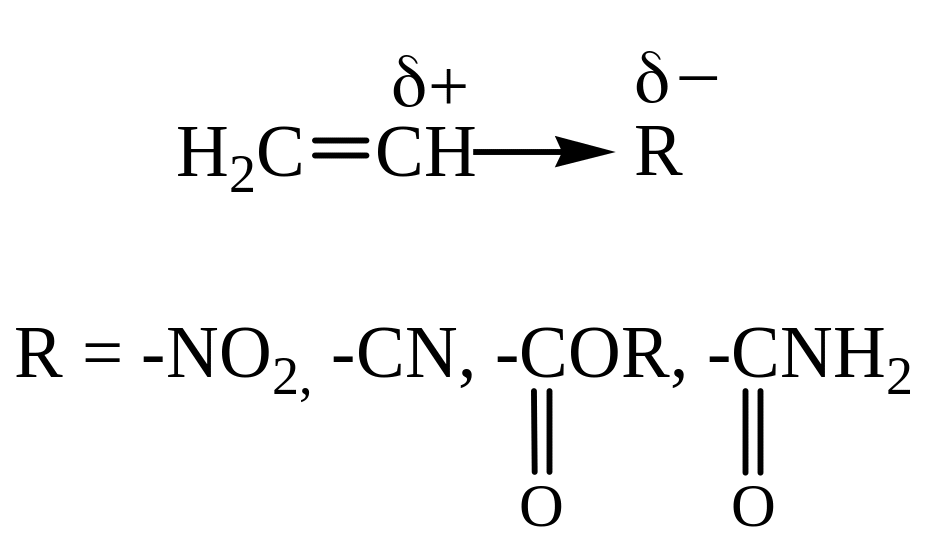
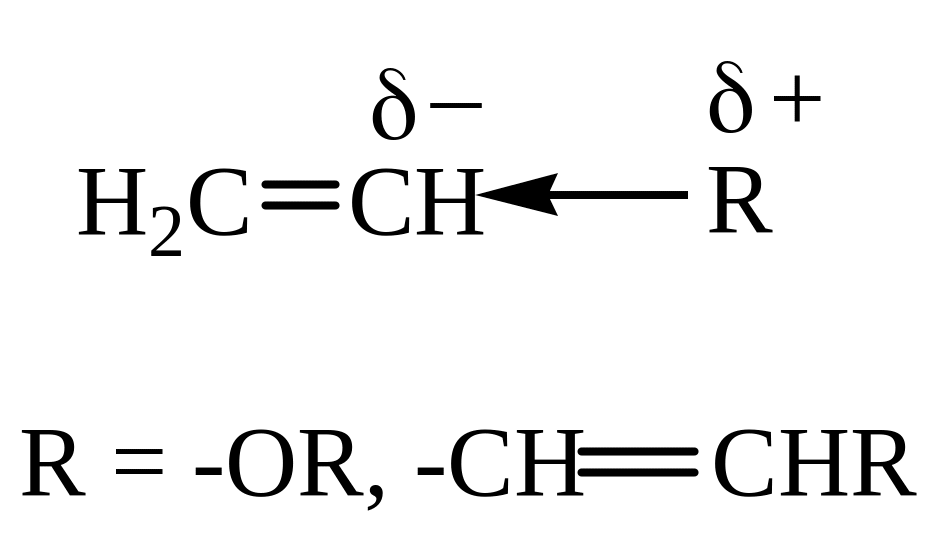
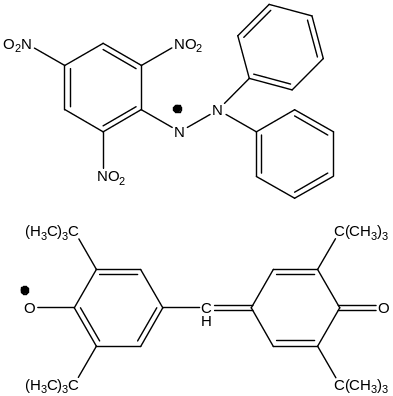
Динамические факторы – мезомерный эффект
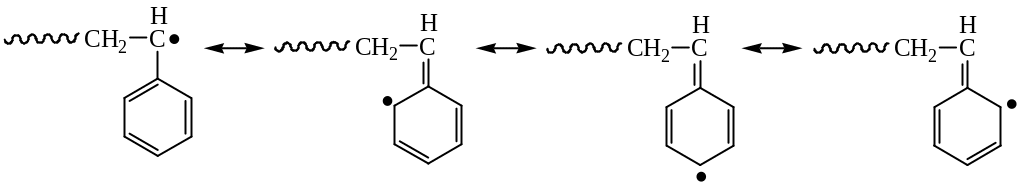
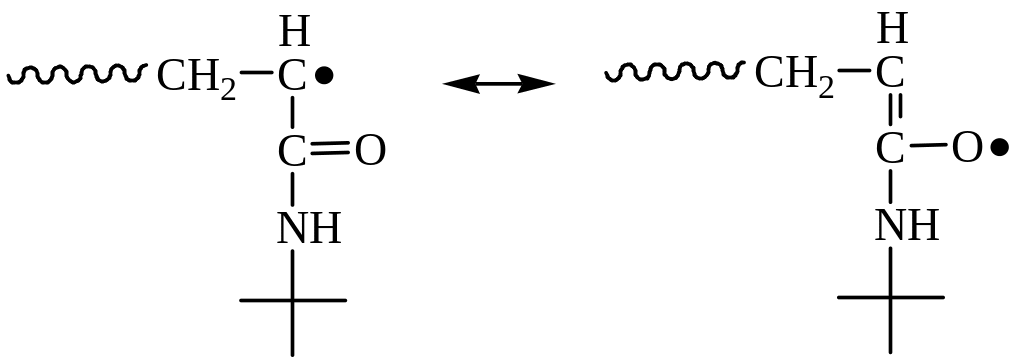
Стерические факторы
Монозамещенные и 1,1-дизамещенные – как правило хорошо полимеризуются
1,2 И более замещенные – как правило, не полимеризуются.
Исключения 1,1-дифенилэтилен и тетрафторэтилен (и их аналоги) по стерическим причинам – в первом случае слишком стерически нагружены, во втором – из-за малого радиуса атома фтора.
Стадии радикальной полимеризации
Инициирование
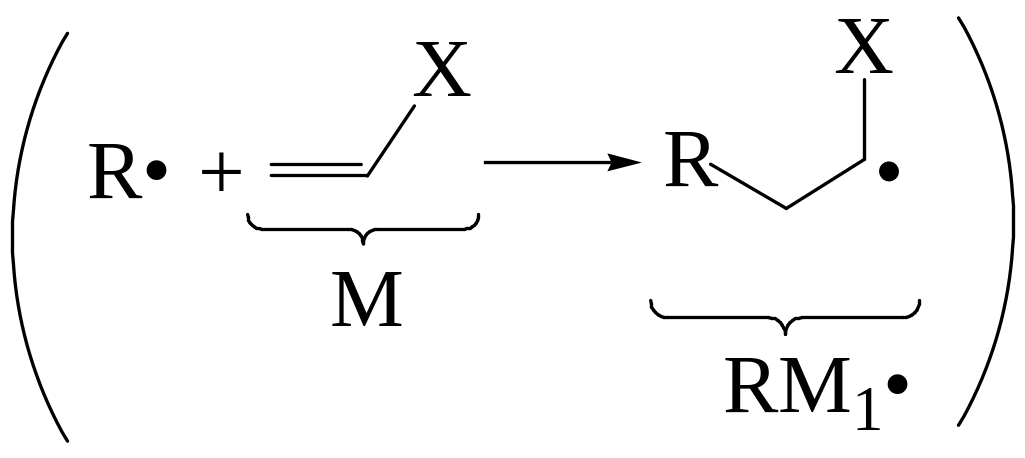
Рост цепи
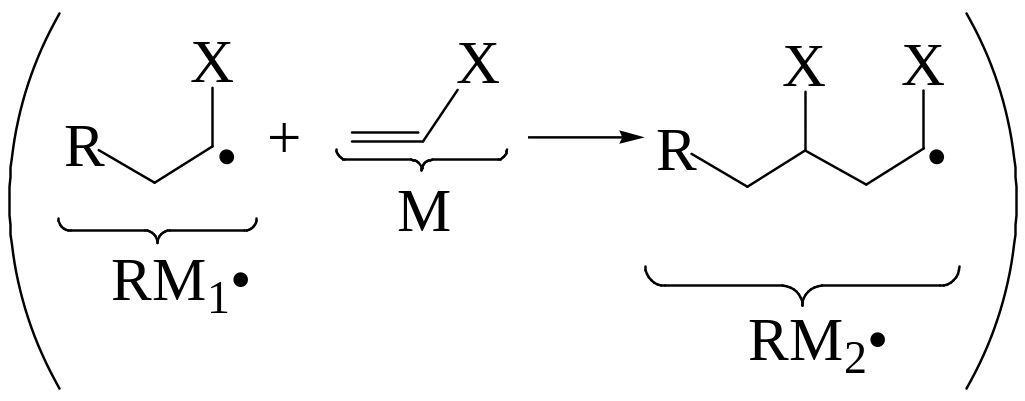
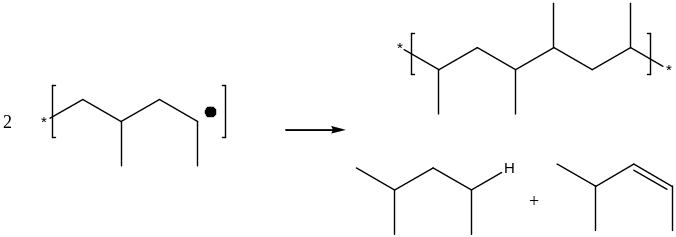
Обрыв цепи
Инициирование.
Различают вещественное и фотохимическое инициирование.
Вещественное инициирование
Термическое инициирование.
Главной характеристикой инициатора является температурный интервал, которому отвечает наиболее приемлемая с практической точки зрения, скорость его распада. Обычно период полупревращения 3-10 час.
Типичные инициаторы
Инициатор |
температура |
К распада 105 сек-1 |
Температура полураспада за 10 часов |
Перекись бензоила |
60 |
0,27 |
65 |
80 |
3,61 |
||
ДИНИЗ |
60 |
0,11 |
64 |
80 |
15,3 |
||
Персульфат калия |
50 |
0,1 |
65 |
80 |
0,45 |
||
дитретбутилперекись |
125 |
1,6 |
125 |
145 |
15,6 |
Типичной характеристикой инициатора является период полураспада при данной температуре. Поскольку разложение инициатора реакция первого порядка, текущую концентрацию инициатора можно определить из уравнения
[I] = [I0] exp (-Kt)
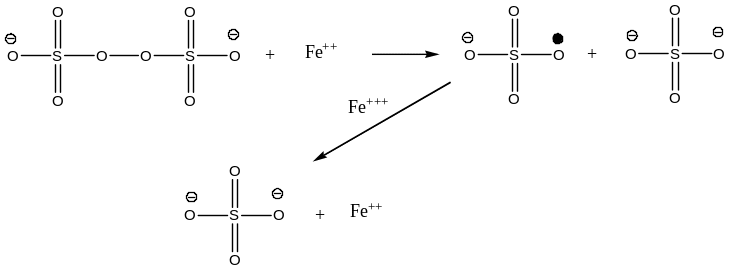
Окислительно-восстановительное инициирование
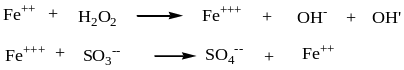
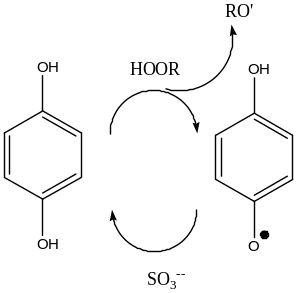
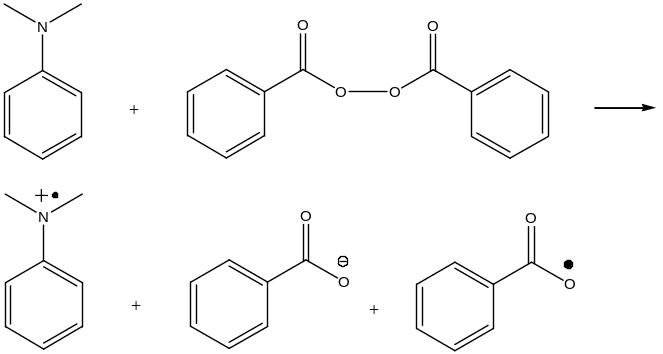
Эффективность использования инициатора
Клеточный эффект
Для количественной характеристики следует рассмотреть соотношение между рекомбинацией и диффузией из клетки растворителя (на расстояние как минимум 2-х диаметров молекулы около 10А) Если принять, что в невязких жидкостях коэффициент диффузии порядка 10-5 см2/сек, а скорость образования радикалов порядка 1013 с-1, то время необходимое для удаления на 10А составит
t = x2/2D = 10-9 c, а за это время произойдет 1013 10-9 = 104 столкновений радикалов
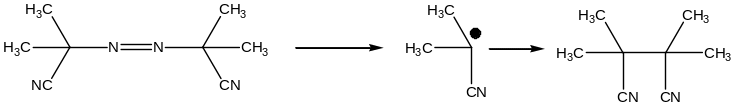
Участие первичных радикалов в реакции индуцированного распада инициатора.
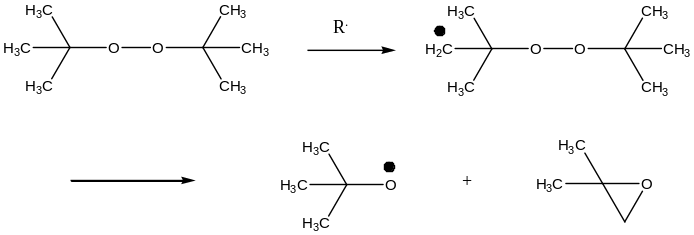
Фотохимическое инициирование

Рост цепи
Стерические факторы
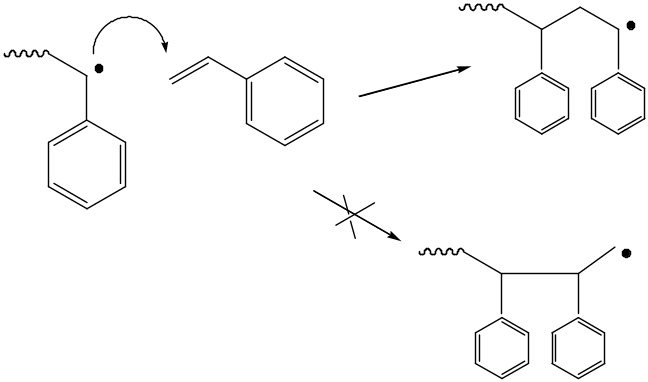
В случае неактивных мономеров может преобладать присоединение голова к голове
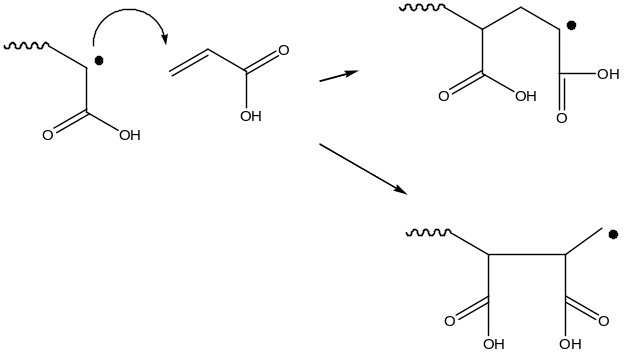
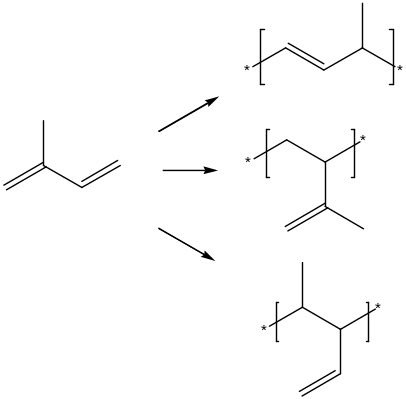
Обрыв цепи
Материальный обрыв
Рекомбинация и диспропорционирование
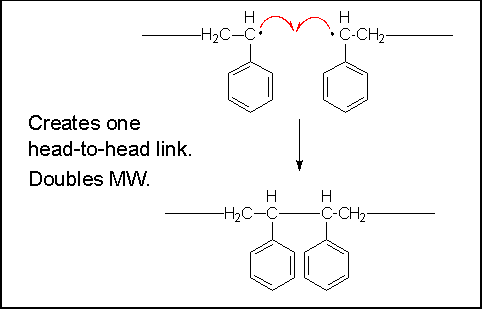
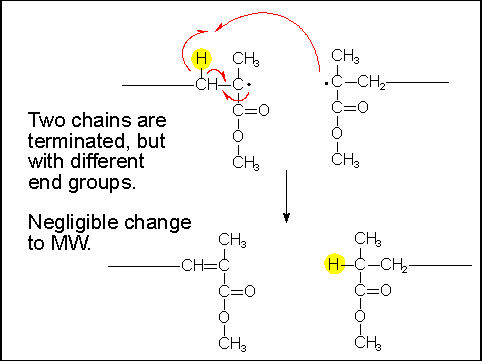
Рекомбинация Е = 0 -1.0 ккал/моль
Диспропорционирование Е = 3-4 ккал/моль
Поскольку из уравнения Аррениуса следует, что K = Аexp (-Е/RT), при низких температурах преобладает рекомбинация, в то время как при более высоких оба процесса конкурируют.
Кинетический обрыв цепи. Реакции передачи.
Передача на полимер
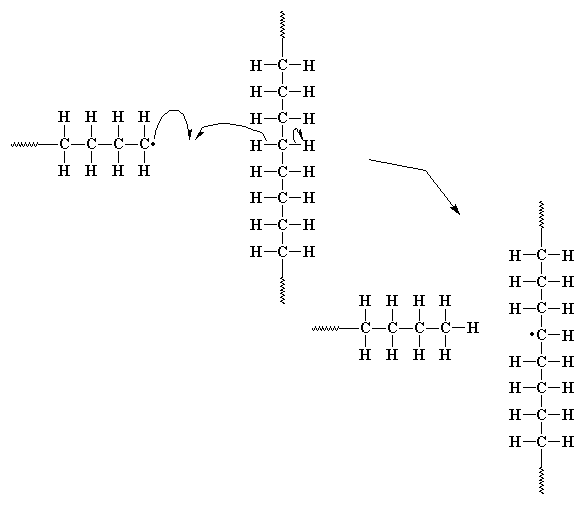
Константы передачи цепи на полимер, 600С
|
К 104 |
Винилацетат |
0,12 |
Метилметакрилат |
0,004 |
стирол |
0,02 |
Передача на растворитель
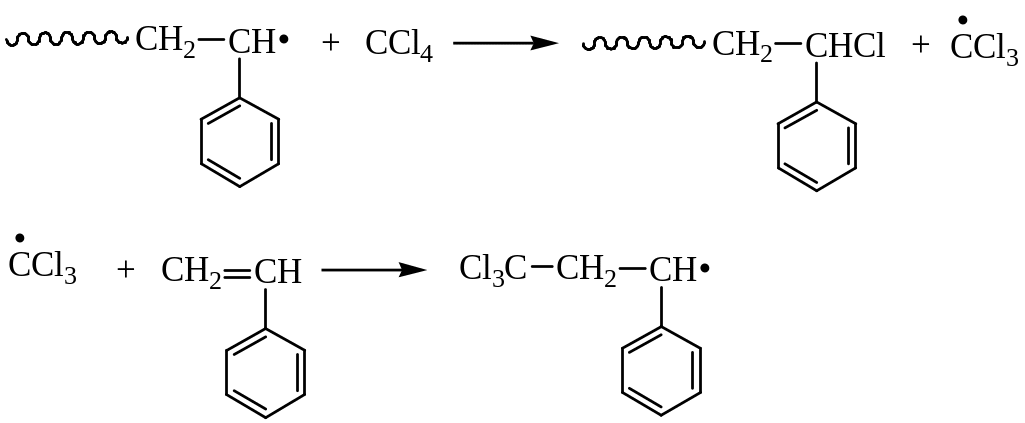
Выбор растворителя
Константы передачи цепи на растворитель, К 104, 600С
|
Стирол |
винилацетат |
Бензол |
0,018 |
3 |
Толуол |
0,125 |
21 |
кумол |
0,82 |
55 |
CCl4 |
90 |
10000 |
CBr4 |
22000` |
390000 |
Бутилмеркаптан |
21000 |
480000 |
Регуляторы роста цепи, теломеризация.
Передача цепи на мономер
Константы передачи цепи на мономер, , 600С
|
К 104 |
Метилметакрилат |
0,1 |
Стирол |
0,45 |
Винилацетат |
2,3 |
винилхлорид |
14 |
Частный случай – полимеризация мономеров аллильного типа

Аллильный радикал недостаточно активен, чтобы полимеризовать двойную связь и способен только к рекомбинации Это т.н. деградационный перенос цепи.
Константа передачи
|
К 104 |
аллилацетат |
180 |
аллилхлорид |
1600 |
В случае аллиловых эфиров и аминов стабилизация радикала связана с бета-эффектом – передачей электронной плотности неподеленной пары через пространство.
Циклополимеризация дилаллиламмнонийных солей
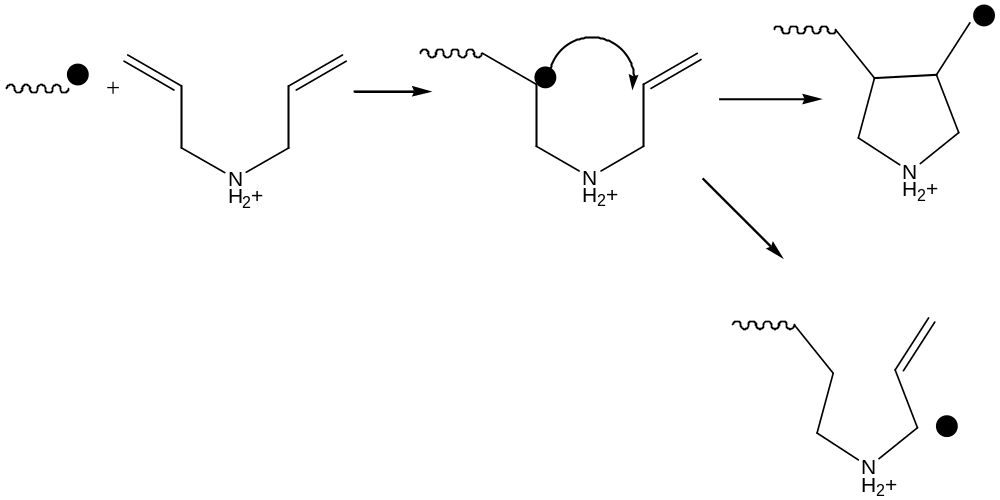
Причина относительно низкой константы деградационного обрыва – стерическая сближенность (энтропийный выигрыш при образогвании пятичленного цикла) и уменьшение скорости реакции внутримолекулярного обрыва альфа-протона
Ингибиторы полимеризации.
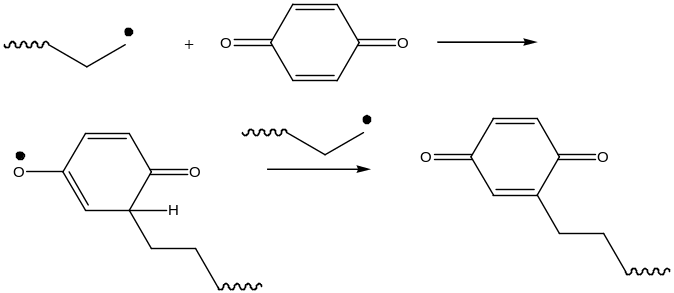
К ингибиторам относятся также стабильные радикалы, соли
металлов переменной валентности (железо, медь), кислород (константа передачи 105)