
- •Передмова
- •Правила роботи в біохімічній лабораторії
- •Правила техніки безпеки при роботі в біохімічній лабораторії
- •Хід роботи
- •1. Екстракція цукрів водою
- •2. Визначення відновлюючих цукрів
- •3. Визначення суми відновлюючих і невідновлюючих цукрів (сахарози)
- •4. Спектрофотометрія
- •Лабораторна робота № 2 Фотоколориметричне визначення тріоз у рослинному матеріалі (за г.Н. Чупахіною, м.В. Куркиною)
- •Хід роботи
- •Обчислення результатів
- •Приклад обчислення
- •Лабораторна робота № 3 Порівняльна оцінка фізико-хімічних властивостей рослинних олій на підставі визначення кислотного і йодного чисел і числа омилення
- •Хід роботи
- •1. Визначення кислотного числа
- •2. Визначення числа омилення
- •3. Визначення йодного числа
- •Лабораторна робота № 4 Визначення вмісту білка в насінні і у вегетативній масі різних культур
- •Хід роботи
- •1. Виділення сумарних білків з насіння зернових і зернобобових рослин
- •2. Спектрофотометричний метод визначення сумарних білків
- •3. Виділення білків з вегетативних органів рослин
- •4. Визначення білків за методом Лоурі
- •Лабораторна робота № 4 Клейковина, її склад і властивості. Визначення кількості та якості сирої клейковини зерна пшениці
- •1. Визначення кількості сирої клейковини
- •Лабораторна робота № 6 Спектрофотометричне визначення нуклеїнових кислот
- •Хід роботи
- •Приклад розрахунку
- •Лабораторна робота № 7 Ферменти, як біологічні каталізатори. Якісні реакції на ферменти
- •1. Відкриття амілази в слині
- •2. Відкриття пероксидази (донор: н2о2 – оксидоредуктаза; кф 1.11.1.7) в картоплі
- •3. Відкриття тирозинази (о-дифенол: о2–оксидоредуктаза; кф 1.10.3.1) у картоплі
- •4. Вплив температури на активність амілази слини
- •5. Вплив рН середовища на активність ферментів
- •Лабораторна робота № 8 Визначення вмісту вільних органічних кислот і кислих солей в плодах методом титрування
- •Хід роботи
- •Лабораторна робота № 9 Колориметричне визначення нітратів (за д. Катальдо та ін.)
- •Хід роботи
- •Лабораторна робота № 10 Колориметричне визначення аскорбінової кислоти в рослинних продуктах
- •Хід роботи
- •Лабораторна робота № 11 Визначення вітамінів в1 і в2 в рослинах
- •Хід роботи
- •1. Екстракція вітамінів
- •2. Одержання тіохрому
- •3. Флуоресцентна спектроскопія розчинів тіохрому і рибофлавіну
- •4. Кількісне визначення вітамінів в1 і в2
- •Лабораторна робота № 12 Виділення l-ментолу з перцевої м'яти
- •Хід роботи
- •Лабораторна робота № 13 Виділення теоброміну і кофеїну з плодів какао та листя чаю. Якісні реакції на алкалоїди
- •1. Виділення теоброміну з какао
- •Хід роботи
- •2. Виділення кофеїну з листя чаю
- •Хід роботи
- •Методична література
- •Розділ II програма курсу «біохімія рослин»
- •Основна література
- •Рекомендована література
- •Реферати і есе
- •Запитання для підготовки
- •Тестові завдання
- •Рекомендована література
- •Реферати та есе
- •Запитання для підготовки
- •Тестові завдання
- •Рекомендована література
- •Реферати та есе
- •Запитання для підготовки
- •Тестові завдання
- •Рекомендована література
- •Реферати та есе
- •Запитання для підготовки
- •Тестові завдання
- •Рекомендована література
- •Реферати та есе
- •Запитання для підготовки
- •Тестові завдання
- •Рекомендована література
- •Реферати та есе
- •Запитання для підготовки
- •Тестові завдання
- •Рекомендована література
- •Реферати та есе
- •Запитання для підготовки
- •Тестові завдання
- •Рекомендована література
Лабораторна робота № 6 Спектрофотометричне визначення нуклеїнових кислот
Рослина є досить важким об'єктом для дослідження нуклеїнових кислот, тим не менш в даний час є чимало методів їх кількісного визначення в різних тканинах, які дозволяють визначати РНК і ДНК в одній наважці. Визначення фосфору РНК і ДНК ведеться на спектрофотометрі при довжині хвиль 270 і 290 нм у свіжому або фіксованому матеріалі. Фіксацію матеріалу можна проводити ліофілізацією або гарячим 96%-ним етанолом.
Попереднє видалення пігментів, кислоторозчинного і ліпідного фосфору є неодмінною умовою спектрофотометричного визначення фосфору РНК і ДНК.
Мета цієї роботи – визначити кількість нуклеїнових кислот в різних тканинах вегетативної маси рослин, насінні та коренеплодах.
Реактиви та матеріали: 0,5 н HClO4, 57%-на HClO4, 5%-на HClO4, 0,2 н NaOH, 96%-ний етанол, 0,5 н KOH, етиловий ефір сульфатної кислоти, дистильована вода, фенолфталеїн, обеззолений "дрібнопористий" фільтр, порцелянова ступка і товкач, скляний пісок, ротатор, конічні колби об'ємом 50 мл, мірні циліндри, пробірки, морозильна камера, центрифуга, вакуум-ексикатор, зворотний повітряний холодильник, термостат, спектрофотометр.
Хід роботи
Для визначення вмісту нуклеїнових кислот наважку досліджуваного матеріалу (5 – 7 г) поміщають в широку пробірку і заливають 10 – 15 мл 0,5 н HClO4, охолодженої до 0 °С. Пробірку з наважкою поміщають в кріогідратну суміш для фіксації. Після фіксації наважку з HClO4 переносять у порцелянову ступку, ретельно розтирають зі скляним піском до гомогенного стану і перемішують на ротаторі 30 хвилин при зниженій температурі. Отриманий гомогенат центрифугують протягом 5 хвилин при 3000 об/хв. Екстракт зливають і ставлять у холодильник. Осад заливають 10 мл 0,5 н HClO4 і перемішують ще 30 хвилин при 0 °С, а потім центрифугують за тих же умов. Екстракти об'єднують в мірній колбі або циліндрі, а осад тричі промивають холодною дистильованою водою по 5 – 7 мл. Промивні води об'єднують з кислотними екстрактами, негайно нейтралізують 0,2 н NaOH по фенолфталеїну і доводять до певного об'єму. Утворені пластівці натрієвої солі хлорної кислоти видаляють центрифугуванням. Нейтралізований хлорнокислий екстракт може бути використаний для визначення вільних аденілових нуклеотидів.
Залишок після видалення кислоторозчинного фосфору тричі обробляють 96%-ним етанолом на холоді. Потім проводять багаторазову екстракцію сумішшю етаноло-сульфатного ефіру (3:1) при кімнатній температурі до повного видалення пігментів. Останній раз залишок промивають етиловим ефіром і висушують у вакуум-ексикаторі. Підготовлена таким чином рослинна маса використовується для визначення нуклеїнових кислот.
Залишок після екстрагування кислоторозчинного і ліпідного фосфору заливають 0,5 н KOH (або NaOH) з розрахунку 10 мл лугу на 100 мг залишку і витримують при 37 °С протягом години. Потім охолоджують і центрифугують 15 хвилин при 4000 об/хв. Надосадову рідину зливають і ставлять у холодильник, а осад після промивання холодним 0,5 н КОН відкидають. Прозорі центрифугати об'єднують і нейтралізують на крижаній бані холодною 57%-ною HClO4 за фенолфталеїном. Потім концентрацію розчину цієї кислоти доводять до 5% її вмісту. На холоді випадає осад ДНК, а в розчині залишається РНК. Через 20 хвилин осад відокремлюють центрифугуванням і два рази (по 5 мл) промивають охолодженою 5%-ною HClO4. Центрифугат, що містить РНК, об'єднують в конічній колбі на 50 мл, закривають зворотним повітряним холодильником і гідролізують на киплячій водяній бані протягом 15 хвилин. Потім охолоджують і фільтрують через скляний фільтр № 4 або через обеззоленний "дрібнопористий" фільтр. Обсяг прозорого фільтрату вимірюють і використовують для спектрофотометричного визначення фосфору РНК.
Осад ДНК за допомогою 5%-ної HClO4 переносять у конічну колбу на 50 мл, закривають зворотним повітряним холодильником і гідролізують 30 хвилин на киплячій водяній бані. Після охолодження і центрифугування рідину зливають у мірну колбу, а осад промивають невеликою кількістю 5%-ної HClO4, центрифугують і надосадову рідину приєднують до першого центрифугату, об'єм доводять до мітки або просто вимірюють. Прозорий розчин спектрофотометрують. Як контроль, проти якого вимірюють оптичну щільність дослідного розчину, беруть 5%-ний розчин HClO4. Оптичну щільність отриманих досвідчених розчинів вимірюють при 270 і 290 нм.
Обчислення концентрації фосфору нуклеїнових кислот (Х) проводять за формулою:
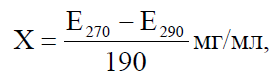
де Е – оптична щільність розчинів при відповідній довжині хвилі. Ділення на 190 дає кількість фосфору нуклеїнової кислоти в 1 мл розчину.
