
- •Физическая химия
- •Москва 2008
- •Предисловие
- •Содержание
- •Работа № 1 определение молярной рефракции жидкостей.
- •Краткое теоретическое введение
- •Последовательность выполнения работы
- •Обработка и оформление результатов
- •Вопросы к работе
- •Последовательность выполнения работы
- •Обработка и оформление результатов
- •Вопросы к работе
- •Последовательность выполнения работы
- •Калибровка и проверка работы стеклянного электрода.
- •Определение константы диссоциации уксусной кислоты:
- •Обработка и оформление результатов
- •Вопросы к работе
- •Последовательность выполнения работы
- •Обработка и оформление результатов.
- •Вопросы к работе
- •Литература
- •Работа № 5 определение скорости разложения комплексного оксалата марганца.
- •Краткое теоретическое введение
- •Последовательность выполнения работы
- •Обработка и оформление результатов
- •Вопросы к работе
- •I метод.
- •I I метод ( графический).
- •III метод ( по периоду полупревращения).
- •Последовательность выполнения работы
- •Обработка и оформление результатов
- •Вопросы к работе
- •Литература.
- •Приложения
- •Атомные рефракции.
- •Изменение энтальпии при образовании водных растворов неорганических веществ и солей органических кислот.
- •Некоторые фундаментальные физико-химические константы.
- •Зимон Анатолий Давыдович, Павлов Андрей Николаевич физическая химия
Вопросы к работе
Что такое водородный показатель? Чему равен рН чистой воды при 25°
Стеклянный электрод. Устройство, принцип действия, применение.
Диссоциация, степень диссоциации. Закон разведения Оствальда.
Концентрация и активность, разница между ними. Когда эти понятия тождественны.
Коэффициент активности, его связь с концентрацией.
Выведите зависимость рН от Кдис. для уксусной кислоты.
Литература.
Зимон А.Д., Зарубин Д.П., Лукина И.Г., Евтушенко А.М., Павлов А.Н., Аксёнов В.Н. Физическая химия. Лабораторный практикум. М.: МГТА, 2003 (лаб. работа 3).
Зимон А.Д., Лещенко Н.Ф. Физическая химия. М.: Высшая школа, 2000.
РАБОТА № 4
ИЗМЕРЕНИЕ ЭЛЕКТРОДВИЖУЩЕЙ СИЛЫ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА.
Цель работы: Приготовление гальванического элемента, измерение его э.д.с. Вычисление э.д.с. элемента при заданных концентрациях солей. Сравнение полученных результатов с вычисленными значениями э.д.с.
Краткое теоретическое введение
Гальванический элемент представляет собой устройство, состоящее из проводников первого (металлы) и второго (электролиты) рода, находящихся в контакте друг с другом. На границах раздела различных проводников, например, металл-раствор, создаются скачки потенциалов, в результате чего в гальваническом элементе возникает электродвижущая сила. При работе гальванического элемента химическая энергия реакции, протекающая нем, переходит в электрическую энергию. Если химическая реакция протекает в элементе обратимо, то и сама цепь будет обратимой, а при этом работа - максимальной.
Примером обратимого гальванического элемента является элемент Якоби-Даниэля, состоящий из медного и цинкового электродов, которые погружены соответственно в растворы CuSO4 и ZnSO4. Элемент Якоби-Даниэля может быть записан схематически:
(-)Zn|ZnSO4||CuSO4|Cu(+),
г де
вертикальная черта означает поверхность
раздела фаз металл-раствор, а две
вертикальные черты - раствор-раствор.
де
вертикальная черта означает поверхность
раздела фаз металл-раствор, а две
вертикальные черты - раствор-раствор.
В результате работы данного элемента на цинковой электроде будут образовываться и переходить в раствор ионы Zn2+; Zn®Zn2++2e, а на медном электроде будут разряжаться ионы Cu2+ и осаждаться металлическая медь.
Cu2+ + 2e® Cu
Во внешней цепи электроны будут переходить от цинкового электрода к медному и будет возникать электродвижущая сила. Суммарный химический процесс выражается уравнением
Cu2+ + Zn ® Cu0 +Zn2+
На границе раздела фаз ZnSO4||CuSO4 возникает диффузионный потенциал, который стремятся свести к минимуму из-за невозможности его измерения при помощи солевого мостика, обычно состоящего из насыщенного раствора электролита, у которого подвижности катиона и аниона одинаковы (КCl, NH4NO3). Элемент Якоби-Даниэля (рис. 4.1.) с применением солевого мостика можно изобразить следующим образом:
(-)Zn|ZnSO4|KCl|CuSO4|Cu(+),
Потенциал металла, погруженного в раствор соли этого металла, определяется уравнением Нернста:
![]() (4.1)
(4.1)
где φ0 - стандартный потенциал электрода,
R - универсальная газовая постоянная,
n - валентность катиона,
a - активность ионов металла,
F - постоянная Фарадея.
Значения стандартных потенциалов определяют по отношению к водородному электроду, стандартный потенциал которого условно принят за ноль. Значения стандартных потенциалов приводятся в справочниках. Итак, для медного электрода имеем:
![]() ,
(4.2)
,
(4.2)
а для цинкового электрода:
![]() ,
(4.3)
,
(4.3)
э.д.с. цепи равна разности потенциалов медного и цинкового электродов:
![]() ,
(4.5)
,
(4.5)
где
![]() а
а
![]() - стандартные значения потенциалов
медного и цинкового электрода
соответственно.
- стандартные значения потенциалов
медного и цинкового электрода
соответственно.
Э.д.с. гальванического элемента характеризует максимальную полезную работу, которая может быть произведена системой при протекании в ней данной химической реакции:
![]() ,
(4.6)
,
(4.6)
где W /m - максимально полезная работа,
DG - изменение энергии Гиббса,
n - число электронов, принимающих участие в электрохимической реакции,
F - постоянная Фарадея,
E - э.д.с. гальванического элемента.
Стандартная э.д.с. гальванического элемента вычисляется по формуле:
![]() ,
(4.7)
,
(4.7)
где Ка - константа равновесия реакции.
Большое значение константы равновесия показывает, что в рассматриваемой реакции равновесие практически целиком смещено в сторону прямой реакции.
Активностью называется термодинамическая величина, позволяющая представить в удобной для практического использования форме концентрационную зависимость химических потенциалов реального раствора. С помощью этой величины можно применять к реальному раствору термодинамические соотношения, относящиеся к идеальному раствору, если заменить в них концентрации активностями.
Активность связана с концентрацией раствора зависимостью:
![]() ,
(4.8)
,
(4.8)
где
![]() - коэффициент активности.
- коэффициент активности.
Коэффициент активности зависит от ионной силы и других свойств раствора. Ионная сила раствора определяется выражением:
![]() ,
(4.9)
,
(4.9)
где ci – молярная концентрация иона,
zi – заряд иона.
Суммирование производится по всем типам ионов, присутствующих в растворе.
Коэффициенты активности индивидуальных ионов в разбавленных растворах в теории межмолекулярных взаимодействий вычисляются по уравнению Дебая-Хюккеля:
![]() ,
(4.10)
,
(4.10)
где А = 0,5092 (дм3/моль)1/2, Ва/ = 1 (дм3/моль)1/2.
Электродвижущая сила гальванического элемента может быть измерена компенсационным методом (рис. 4.2).
Сущность метода компенсации состоит в том, что электродвижущая сила исследуемого элемента уравновешивается падением напряжения от аккумулятора на части АК реохорда АВ.
Для питания реохорда к его концам присоединяют аккумулятор 1. Если проволока АВ на реохорде совершенно однородна, то на единицу длины проволоки приходится падение напряжения Еак/АВ.
Для определения
э.д.с.
исследуемого элемента 2 его присоединяют
в боковую цепь так, чтобы направление
тока элемента было противоположным
току аккумулятора. Передвигая подвижный
контакт 8 вдоль проволоки АВ,
можно найти такое его положение, при
котором падение напряжения аккумулятора
на участке АК
равно э.д.с.
исследуемого элемента. Гальванометр 3
в боковой цепи покажет отсутствие тока,
а искомая э.д.с.
элемента будет равна:
![]() ,
где Ех,
Еак
- соответственно
электродвижущая сила исследуемого
элемента и аккумулятора, АК
- отрезок проволоки, на котором падение
напряжения аккумулятора равно э.д.с.
исследуемого
элемента.
,
где Ех,
Еак
- соответственно
электродвижущая сила исследуемого
элемента и аккумулятора, АК
- отрезок проволоки, на котором падение
напряжения аккумулятора равно э.д.с.
исследуемого
элемента.
Рис.
4.2. Схема
установки для измерения Э.Д.С.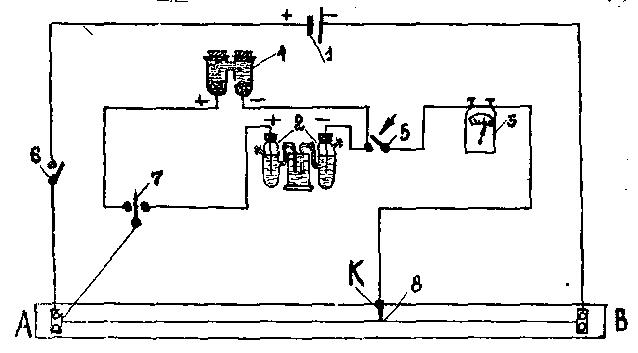
Непосредственно из предыдущего уравнения величина Ех вычислена быть не может, так как неизвестно значение Еак. Чтобы обойти это затруднение, в боковую цепь вместо исследуемого элемента включают нормальный элемент Вестона 4, который обладает хорошо известной и устойчивой э.д.с. Ео.
Скомпенсировав
э.д.с.
нормального
элемента, получим:
![]() ,
где АВо
- отрезок проволоки, на котором падение
напряжения аккумулятора равно э.д.с.
нормального
элемента. Проведя преобразования,
получим
,
где АВо
- отрезок проволоки, на котором падение
напряжения аккумулятора равно э.д.с.
нормального
элемента. Проведя преобразования,
получим
![]() .
.
По этому уравнению непосредственно можно вычислить величину э.д.с. исследуемого элемента.
Для точных измерений э.д.с. пользуются высокоомными потенциометрами постоянного тока и другими приборами, в основу принципа действия которых положена приведенная ранее компенсационная схема.
Схема экспериментальной установки
Для проведения измерений используется универсальный мультиметр типа UТ-54 (фирма «UNI-T»).
