
- •Физическая химия
- •Москва 2008
- •Предисловие
- •Содержание
- •Работа № 1 определение молярной рефракции жидкостей.
- •Краткое теоретическое введение
- •Последовательность выполнения работы
- •Обработка и оформление результатов
- •Вопросы к работе
- •Последовательность выполнения работы
- •Обработка и оформление результатов
- •Вопросы к работе
- •Последовательность выполнения работы
- •Калибровка и проверка работы стеклянного электрода.
- •Определение константы диссоциации уксусной кислоты:
- •Обработка и оформление результатов
- •Вопросы к работе
- •Последовательность выполнения работы
- •Обработка и оформление результатов.
- •Вопросы к работе
- •Литература
- •Работа № 5 определение скорости разложения комплексного оксалата марганца.
- •Краткое теоретическое введение
- •Последовательность выполнения работы
- •Обработка и оформление результатов
- •Вопросы к работе
- •I метод.
- •I I метод ( графический).
- •III метод ( по периоду полупревращения).
- •Последовательность выполнения работы
- •Обработка и оформление результатов
- •Вопросы к работе
- •Литература.
- •Приложения
- •Атомные рефракции.
- •Изменение энтальпии при образовании водных растворов неорганических веществ и солей органических кислот.
- •Некоторые фундаментальные физико-химические константы.
- •Зимон Анатолий Давыдович, Павлов Андрей Николаевич физическая химия
Содержание
ФИЗИЧЕСКАЯ ХИМИЯ 1
ПРЕДИСЛОВИЕ 3
Содержание 3
РАБОТА № 1 5
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ РЕФРАКЦИИ ЖИДКОСТЕЙ. 5
РАБОТА № 2 11
ТЕРМОХИМИЧЕСКИЕ ИЗМЕРЕНИЯ. 11
РАБОТА № 3 16
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ СЛАБОЙ КИСЛОТЫ. 16
РАБОТА № 4 22
ИЗМЕРЕНИЕ ЭЛЕКТРОДВИЖУЩЕЙ СИЛЫ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА. 22
РАБОТА № 5 28
ОПРЕДЕЛЕНИЕ СКОРОСТИ РАЗЛОЖЕНИЯ КОМПЛЕКСНОГО ОКСАЛАТА МАРГАНЦА. 28
РАБОТА № 6 33
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ ИНВЕРСИИ САХАРОЗЫ. 33
ПРИЛОЖЕНИЯ 41
Работа № 1 определение молярной рефракции жидкостей.
Цель работы: Определить величины молярной рефракции жидкостей и сравнить их с вычисленными по правилу аддитивности рефракции.
Краткое теоретическое введение
Молекула любого вещества состоит из положительно заряженных колеблющихся ядер атомов и вращающихся вокруг ядер отрицательно заряженных электронов. Суммы зарядов ядер (+ е) и электронов (-е) равны друг другу, так что молекула в целом электронейтральна.
Молекулы, у которых центры тяжести положительных и отрицательных зарядов совпадают (находятся в центре симметрии) называются неполярными. Это например, одноатомные молекулы Не, Ne, Ar, двухатомные H2, O2, N2 и многие многоатомные молекулы, обладающие высокой симметрией, С6Н6 CS2 и др.
Если в отсутствии внешнего электрического поля центры тяжести положительных и отрицательных зарядов не совпадают и находятся на некотором расстоянии друг от друга l, то молекула обладает положительным дипольным моментом μ.
μ=еּ l. (1.1)
Н2О, NO, NH3 являются примерами таких несимметричных, полярных молекул.
Единицей дипольного момента является Дебай (Д) 1 Д=3,3564ּ10-30 Кл.м.
Если неполярную молекулу, поместить в электрическое поле, то возникает явление поляризации, состоящее в смещении зарядов (деформационная поляризация). Электроны, обладающие незначительной массой, сильно сдвигаются в сторону положительного полюса электрического поля, ядра атомов, более тяжелые, несколько смещаются в противоположном направлении. Возникает индуцированный (наведенный) дипольный момент, пропорциональный напряженности поля:
μинд. = αд. ּ F, (1.2)
где F - напряженность внутреннего поля диэлектрика, молекулы;
αд. –деформационная поляризуемость, характеризующая способность молекулы деформироваться под действием электрического поля.
αд. = αат. + αэл., (1.3)
где αат., αэл.— соответственно атомная и электронная поляризуемости, характеризующие способность отрицательных и положительных зарядов молекулы смещаться друг относительно друга. Полярные молекулы в электрическом поле испытывают деформационную поляризацию. Кроме того, под влиянием поля они ориентируются вдоль его силовых линий, стремясь принять устойчивое положение, отвечающее минимуму потенциальной энергии. Этот эффект называется ориентационной поляризацией:
![]() ,
(1.4)
,
(1.4)
где αор.– ориентационная поляризуемость,
k – постоянная Больцмана,
T – абсолютная температура.
Ориентационная поляризуемость уменьшается с ростом температуры, так как тепловое движение препятствует ориентации молекул.
Полная поляризуемость α является суммой трех величин :
α = αэл. + αат. + αор.. (1.5)
Все изменения, происходящие в структуре молекулы под воздействием внешнего электрического поля называются электрической поляризацией веществ П или просто поляризацией.
Существует три вида поляризации:
1. Электронная поляризация Пэл., возникающая в результате упругого смещения и деформации электронных облаков относительно поля ядер:
Пэл. =4/3 π NA αэл, (1.6)
где NA– постоянная Авогадро.
Время установления электронной поляризации 10-15 с, поэтому ее называют мгновенной.
2. Атомная или ядерная поляризация Пат., возникающая в результате смещения ядер атомов или атомных групп:
Пат.= 4/3 π NA αат. (1.7)
3. Ориентационная поляризация Пор., отражающая стремление полярных молекул ориентироваться под действием внешнего электрического поля:
Пор.
= 4/3 π NA![]() (1.8)
(1.8)
Общая поляризация П/ для полярных молекул равна:
П/ = Пор.+ Пат.+ Пэл. = 4/3 π NA + 4/3 π NA αэл. + 4/3 π NA αат. (1.9)
Для неполярных молекул П// равна:
П// = Пат.+ Пэл. = 4/3 π NA αэл. + 4/3 π NA αат. (1.10)
Для молекул, имеющих форму шара, П// примерно равна объему молекул, находящихся в одном моле вещества.
Мольная поляризация диэлектрика вычисляется по формуле:
![]() ,
(1.11)
,
(1.11)
где ε – относительная диэлектрическая проницаемость,
М – молярная масса,
ρ – плотность.
В переменном поле вид и величина поляризации зависят от частоты электромагнитного поля. Общая поляризация уменьшается с увеличением частоты приложенного поля. Ориентационная поляризация стремится к нулю при частотах поля до 1010 Гц, когда ориентация полей не поспевает за изменением поля. Атомная поляризация исчезает при частоте 1013 Гц (ядра атомов и молекулярных групп не успевают смещаться). Если частота колебаний превышает 1013 Гц, поляризация молекул осуществляется только за счет смещения электронов.
Таким образом, действием быстропеременного электромагнитного поля лучей видимого света, частота колебаний которого имеет порядок 1015 Гц, в молекуле может быть вызвана только электронная поляризация.
По Максвеллу для электромагнитных волн с бесконечно большой длиной волны ε = n2, где n - коэффициент преломления. Поэтому из уравнения (1.11) следует:
![]() .
(1.12)
.
(1.12)
Величину R называют молярной рефракцией. Рефракция имеет размерность [м3/моль].
Рефракция - мера поляризуемости молекулярной электронной оболочки.
Многолетние экспериментальные исследования рефракции выявили ряд закономерностей, связывающих её со строением и составом веществ. Важнейшим из них является правило аддитивности рефракций: молярная рефракция вещества равна сумме молярных рефракций его составных частей. В этом качестве могут рассматриваться атомы, группы атомов, функциональные группы, а также химические связи между атомами. Наиболее распространенными являются рефракции атомов и связей, значения которых можно найти в справочниках.
Зная строение молекулы вещества и рефракции атомов(связей), можно вычислить молярную рефракцию вещества по формуле:
R
= Σ![]() i
Ri
,
(1.13)
i
Ri
,
(1.13)
где Ri— рефракции атомов или связей в молекуле,
i – стехиометрическое число атомов или связей в молекуле данного вещества.
Правило аддитивности может быть использовано для установления строения молекулы: сравнивают R, найденную из данных опыта и рассчитанную по уравнению (1.12) с рефракцией, вычисленной по уравнению (1.13) для предполагаемой структуры. Совпадение результатов служит подтверждением предполагаемого строения. Расхождение до 0,2ּ10-6 – 0,4ּ10-6 м3/моль относятся за счет возможных ошибок опыта и неточности самих аддитивных констант.
Особенно
сильно расхождения между экспериментальной
рефракцией и рефракцией, вычисленной
по правилу аддитивности, встречаются
при изучении веществ с сопряжёнными
двойными связями и частичной делокализацией
![]() -электронов.
Делокализованные электроны могут
перемещаться по всему участку сопряжения,
поэтому они дают больший вклад в
деформационную поляризуемость молекулы.
Это приводит к аномально большой
рефракции – явлению экзальтации
рефракции.
-электронов.
Делокализованные электроны могут
перемещаться по всему участку сопряжения,
поэтому они дают больший вклад в
деформационную поляризуемость молекулы.
Это приводит к аномально большой
рефракции – явлению экзальтации
рефракции.
В физико-химических исследованиях также используется величина удельной рефракции r:
![]() . (1.14)
. (1.14)
Схема экспериментальной установки
Р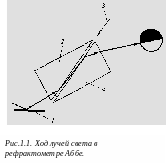 ефрактометр
Аббе предназначен для измерения
показателей преломления жидкостей в
пределах от 1,33 до 1,70. Принцип работы
рефрактометра Аббе основан на определении
угла полного внутреннего отражения.
Исследуемое вещество помещают между
двумя прямоугольными призмами 2
и 4
(рис. 1.1.). Свет от зеркала 1
отражается на прямоугольную призму 2.
Преломившись на границе раздела воздух
— стекло, луч света попадает на границу
раздела стекло — исследуемое вещество
3. Если постепенно увеличивать угол
падения, то при некотором угле выходящий
луч света будет направляться вдоль
грани призмы, т.е. наступит полное
внутреннее отражение. Угол, при котором
наступает полное внутреннее отражение,
зависит от показателей преломления
призмы и исследуемого вещества 3.
Показатель
преломления призмы есть величина
постоянная.
ефрактометр
Аббе предназначен для измерения
показателей преломления жидкостей в
пределах от 1,33 до 1,70. Принцип работы
рефрактометра Аббе основан на определении
угла полного внутреннего отражения.
Исследуемое вещество помещают между
двумя прямоугольными призмами 2
и 4
(рис. 1.1.). Свет от зеркала 1
отражается на прямоугольную призму 2.
Преломившись на границе раздела воздух
— стекло, луч света попадает на границу
раздела стекло — исследуемое вещество
3. Если постепенно увеличивать угол
падения, то при некотором угле выходящий
луч света будет направляться вдоль
грани призмы, т.е. наступит полное
внутреннее отражение. Угол, при котором
наступает полное внутреннее отражение,
зависит от показателей преломления
призмы и исследуемого вещества 3.
Показатель
преломления призмы есть величина
постоянная.
В приборе изменяют угол наклона призмы относительно зеркала до тех пор, пока граница раздела освещенной и темной половины не будет установлена точно на перекрестие в поле зрения окуляра. На шкале рефрактометра непосредственно нанесены значения показателей преломления с точностью до 5∙10-4. На рефрактометре Аббе показатель преломления измеряется в белом свете. При появлении спектра на границе раздела необходимо изменить положение призм компенсаторов, которые вращаются маховиком, расположенным справа от зрительной трубы.
