
8.5. Условия фазового равновесия.
Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического и химического равновесия.
Типы фазовых равновесий:
Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковуютемпературу.
Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Строго говоря, в реальных системах эти давления равны лишь приближенно, разность давлений создается поверхностным натяжением.
Химическое равновесие выражается в равенстве химических потенциалов всех фаз вещества.
Условие равновесия фаз.
Рассмотрим химически однородную систему (состоящую из частиц одного типа). Пусть в этой системе имеется граница раздела между фазами 1 и 2. Как было указано выше, для равновесия фаз требуется равенство температур и давлений на границе раздела фаз. Известно (см. статью Термодинамические потенциалы), что состояние термодинамического равновесия в системе с постоянными температурой и давлением соответствует точке минимума потенциала Гиббса.
Потенциал Гиббса такой системы будет равен
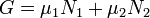 ,
,
где ![]() и
и ![]() — химические
потенциалы, а
— химические
потенциалы, а ![]() и
и ![]() —
числа частиц в первой и второй фазах
соответственно.
—
числа частиц в первой и второй фазах
соответственно.
При этом сумма ![]() (полное
число частиц в системе) меняться не
может, поэтому можно записать
(полное
число частиц в системе) меняться не
может, поэтому можно записать
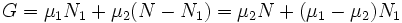 .
.
Предположим, что ![]() ,
для определенности,
,
для определенности, ![]() .
Тогда, очевидно, минимум потенциала
Гиббса достигается при
.
Тогда, очевидно, минимум потенциала
Гиббса достигается при![]() (все
вещество перешло в первую фазу).
(все
вещество перешло в первую фазу).
Таким образом, равновесие фаз возможно только в том случае, когда химические потенциалы этих фаз по разные стороны границы раздела равны:
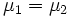 .
.
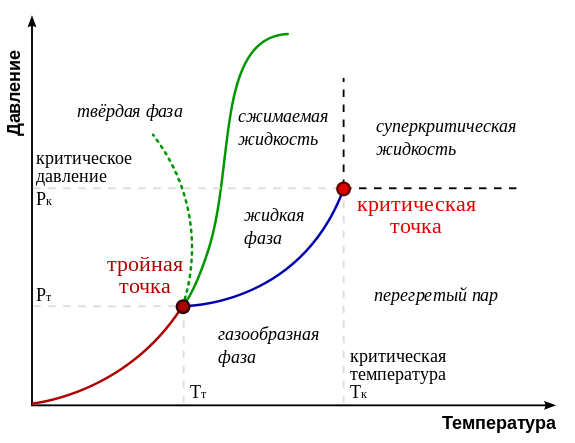
8.6. Тройная точка.
Тройна́я то́чка — точка на фазовой диаграмме, где сходятся три линии фазовых переходов. Тройная точка — это одна из характеристик вещества. Обычно тройная точка определяется значением температуры и давления, при котором вещество может равновесно находиться в трёх (отсюда и название) агрегатных состояниях: твёрдом, жидком и газообразном. В этой точке сходятся линии плавления, кипения и сублимации.
В более общем случае могут рассматриваться и другие фазы вещества, не соответствующие различным агрегатным состояниям. На достаточно богатых фазовых диаграммах может быть несколько тройных точек. Вещество в тройной точке в состоянии термодинамического равновесия может частично находиться во всех трёх фазах. На многомерных фазовых диаграммах (то есть если кроме температуры и давленияприсутствуют иные интенсивные величины) могут существовать четверные и т. д. точки.
8.7. Диграмма состояния.

8.8 Уравнение Клапейрона-Клаузиуса.
Из условия равновесия
фаз можно получить зависимость давления
в равновесной системе от температуры.
Если говорить о равновесии жидкость
— пар, то под
давлением понимают давление насыщенных
паров, а зависимость ![]() называется кривой
испарения.
называется кривой
испарения.
Из условия равенства химических потенциалов следует условие равенства удельных термодинамических потенциалов:
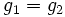 ,
,
где ![]() ,
, ![]() —
потенциал Гиббса i-й фазы,
—
потенциал Гиббса i-й фазы, ![]() —
её масса.
—
её масса.
Отсюда:
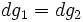 ,
,
а значит,
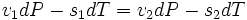 ,
,
где ![]() и
и ![]() —
удельные объем и энтропия фаз.
Отсюда следует, что
—
удельные объем и энтропия фаз.
Отсюда следует, что
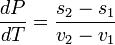 ,
,
и окончательно
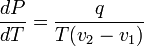 ,
,
где ![]() —
удельная теплота фазового перехода
(например, удельная
теплота плавления или удельная
теплота испарения).
—
удельная теплота фазового перехода
(например, удельная
теплота плавления или удельная
теплота испарения).
Последнее уравнение называется уравнением Клапейрона — Клаузиуса.
