
- •1.Приготування стандартного розчину naoh
- •2.Встановлення концентрації р-ну naoh за оксалатною к-ю
- •7. Визначення Fe в р-ні солі Мора перманганатометричн.Методом
- •6.Стандартизація р-ну kMnO4 за оксалатною кислотою
- •1.Натрію тіосульфат реагує з карбонатною кислотою, розчиненою у воді:
- •2.Натрію тіосульфат оксидується киснем повітря:
- •9. Приготування вихідного р-ну йоду
- •10. Йодометричне визначення відновників методом прямого титрування
- •11.Приготування 0,1м р-ну AgNo3
- •12.Стандартизація 0,1м р-ну AgNo за NaCl
- •13.Визначення % вмісту cl в зразку кухонної солі за метолом Мора
- •14.Приготування 0,1 м р-ну амонію роданіду
- •15. Приготування 0,05 р-ну трилону б
- •16. Визначення загальної твердості води
- •4. Встановлення концентр. Hcl за бурою
1.Приготування стандартного розчину naoh
Найчастіше готують 0,1М розчин натрію гідроксиду. Однак останній гігроскопічний і легко реагує з СО2 повітря. Тому NaОН завжди містить змінні кількості вологи і карбонатів. Крім того, в натрію гідрокисді часто бувають інші домішки, наприклад, хлориди, сульфати, тощо. Тому спочатку готують приблизний 0,1М розчин натрію гідроксиду, а точну концентрацію визначають за вихідною речовиною.
2.Встановлення концентрації р-ну naoh за оксалатною к-ю
Оксалатна кислота (СООН)2•2Н2О кристалізується з двома молекулами води.Концентрація розчину NaОН встановлюється за перекристалізованою оксалатною кислотою. Для перекристалізації готують насичений гарячий р-н кислоти. Розчин, якщо потрібно, фільтрують і швидко охолоджують. Виділені кристали відсмоктують на лійці Бюхнера, промивають 1-2 рази холодною водою. Вологий порошок висушують на повітрі.Зберігають в склянках з притертим корком. Ок-на кислота часто містить домішки__солі кальцію. У цьому випадку оксалатну кислоту необхідно спочатку перекристалізувати із розчину хлоридної кислоти, а потім із води.
5. Приготування приблизно 0,1 н р-ну KMnO4
Розчин готують приблизної концентрації, наважку беруть дещо більшу, ніж потрібну за розрахунками, а потім титр його встановлюють за вихідною речовиною.Для приготування 1 дм3 0,1н розчину наважка дорівнює:
m = 31,61 • 0,1 = 3,161 г.Відважують на технічних терезах приблизно 3,2 г KMnO4, розчиняють наважку в гарячій воді і доводять об’єм розчину холодною водою до 1 дм3. Розчин залишають стояти 7-10 днів, щоб домішки, які є в розчині повністю оксидувались. Після цього приготований розчин відфільтровують через скляну вату від утвореного мангану (IV) оксиду, а потім його титр встановлюють по вихідній речовині – оксалатній кислоті або її солі. Склянку з приготованим розчином калію перманганату закривають скляним корком і ставлять у темне місце.
7. Визначення Fe в р-ні солі Мора перманганатометричн.Методом
Сіль Мора має склад (NH4)2SO4•FeSO4•6H2O. .
Отриманий в мірній колбі розчин (з невідомим вмістом заліза) доводять до мітки дистильованою водою і добре перемішують. Відбирають піпеткою 20 см3 (25 см3) цього розчину, переносять у конічну колбу, додають 20 см3 (25 см3) 1М розчину сульфатної кислоти і титрують робочим розчином калію перманганату до появи блідо-рожевого забарвлення, яке не зникає протягом 30 секунд. Проводять не менше трьох титрувань, що розраховують середнє значення об’єму розчину KMnO4, що пішов на титрування.Концентрацію розчину солі Мора обраховують за формулою:
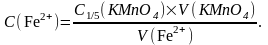 Вміст
феруму в розчині солі Мора розраховують
за формулою:
Вміст
феруму в розчині солі Мора розраховують
за формулою:

6.Стандартизація р-ну kMnO4 за оксалатною кислотою
У колбу для титрування піпеткою переносять 20-25 см3 розчину оксалатної кислоти або натрію оксалату, додають циліндром 20-25 см3 1М розчину сульфатної кислоти і нагрівають до 80-85˚С .
Розчин калію перманганату наливають у бюретку і встановлюють меніск на нулю. Нижній край меніску погано видно внаслідок темного забарвлення розчину, тому всі підрахунки ведуть за верхнім краєм меніску. Розчин з бюретки доливають по краплях, причому кожну краплю додають після того, як зникне забарвлення.
Перші краплі обезбарвлюються повільно. Але, як тільки утвориться небагато йонів Mn2+, які каталізують цю реакцію, подальше обезбарвлення проходить практично миттєво. Титрування закінчують, коли одна додана крапля розчину калію перманганату забарвить розчин у блідо-рожевий колір, який не зникає протягом 30 секунд.
Титрування проводять не менше трьох разів (якщо різниця між ними не перевищує 0,1 см3) і беруть середнє значення.
Концентрацію розчину KMnO4 розраховують за формулою:
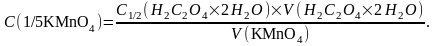
8. Приготування 0,1М р-ну Na2S2O3•5H2O
Приготувати титрований розчин натрію тіосульфату за точною наважкою не можна за наступними причинами:
