
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект лекций физическая химия
- •Введение
- •Физическая химия
- •Термодинамика Введение Историческая справка
- •Задачи термодинамики
- •Понятия и определения
- •Внутренняя энергия системы
- •Теплота и работа
- •Первый закон термодинамики
- •Применение первого закона термодинамики к процессам в идеальных газах
- •Теплоемкость
- •Приближенные правила расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Теории теплоемкости Классическая кинетическая теория
- •Теория теплоемкости Эйнштейна-Дебая (квантовая теория) для твердого вещества 1907 г
- •Усовершенствования в теорию Эйнштейна внес Дебай
- •Квантовостатистическая теория газов
- •Тепловые эффекты химических реакций Закон Гесса. Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта методом алгебраического суммирования термохимических уравнений
- •Вычисление теплового эффекта графическим методом (методом термохимических схем)
- •Вычисление теплового эффекта по стандартным энтальпиям образования
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования
- •Вычисление теплового эффекта по стандартным энтальпиям сгорания
- •Вычисления общего количества теплоты, необходимого для нагревания вещества
- •Зависимость теплового эффекта реакции от температуры
- •Второй закон термодинамики. Энтропия
- •Определение энтропии по Больцману (термодинамическая вероятность)
- •Изменение энтропии в некоторых процессах
- •Изменение энтропии при фазовых превращениях
- •Изменение энтропии при изотермическом расширении (сжатии) 1 моль идеального газа
- •Изменение энтропии при нагревании системы
- •Изменение энтропии при кристаллизации переохлажденной жидкости
- •Изменение энтропии химической реакции
- •Изменение энтропии идеального газа
- •Термодинамические потенциалы
- •Характеристические функции
- •Уравнения Гиббса-Гельмгольца
- •Третий закон термодинамики
- •Парциальные молярные величины
- •Уравнения Гиббса-Дюгема
- •Следствия из уравнений Гиббса-Дюгема
- •Относительные пм свойства
- •Кажущиеся молярные величины
- •Методы определения парциальных молярных величин
- •Химический потенциал
- •Зависимость химического потенциала от температуры
- •Химический потенциал в газах
- •Химический потенциал в растворах
- •Химическое равновесие Константа равновесия. Закон действующих масс
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Принцип Ле-Шателье и влияние различных факторов на химическое равновесие
- •Уравнение изобары химической реакции
- •Метод приведенных энергий Гиббса Метод Темкина-Шварцмана Равновесие в гетерогенной системе
- •Условие равновесия в гетерогенной системе
- •Константа равновесия гетерогенной системы
- •Фазовые равновесия Основные понятия и определения
- •Правило фаз Гиббса
- •Уравнение Клаузиуса-Клапейрона
- •Применение уравнения Клаузиуса-Клапейрона к различным процессам
- •Равновесия с участием растворов
- •Термодинамические условия образования растворов
- •Закон Рауля
- •Растворимость газов
- •Растворимость твердых веществ. Уравнение Шредера
- •Зависимость растворимости твердых веществ от давления
- •Температура кипения раствора
- •Температура замерзания раствора
- •Осмотическое давление
- •Фазовые диаграммы Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные неконденсированные системы
- •Двухкомпонентные конденсированные системы Построение диаграмм
- •Типовые диаграммы состояния конденсированных систем
- •Трехкомпонентные конденсированные системы
- •Треугольник Гиббса
- •Метод Розебума
- •Правило луча
- •Сечения объемной диаграммы
- •Проекция нескольких сечений
- •Диаграмма состояния трехкомпонентной конденсированной системы без химических соединений и фазовых превращений
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся без разложения
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся с разложением
- •Компоненты системы образуют одно тройное химическое соединение s с конгруэнтной точкой плавления.
- •Водно-солевые системы
- •Диаграмма состояния трехкомпонентной водно-солевой системы без кристаллогидратов и двойных солей
- •Диаграмма растворимости двух солей с одноименным ионом в случае образования двойной соли
- •Кристаллизация соли ах сопровождается связыванием определенного количества кристаллизационной воды с образованием кристаллогидрата
- •Кристаллизация соли ах сопровождается появлением двойной соли с образованием кристаллогидрата этой двойной соли
- •Электрохимия Введение
- •Историческая справка о науке электрохимии
- •Растворы электролитов Основные понятия и определения
- •Историческая справка о природе растворов электролитов
- •О сольватации и ассоциации Ассоциация
- •Сольватация
- •Термохимическая теория растворения электролитов
- •Теория гидратации Борна
- •Метод активностей
- •Теория Дебая-Хюккеля
- •Электрическая проводимость растворов Введение
- •Зависимость электропроводности от температуры
- •Движение ионов в электрическом поле. Числа переноса ионов
- •Зависимость удельной электрической проводимости растворов электролитов от концентрации
- •Метод кондуктометрии
- •Термодинамика электродных систем Введение
- •Закон Фарадея
- •Электроды, цепи, их схематическая запись
- •Правила записи электродов и цепей
- •Возникновение скачка потенциала на границе раствор-металл
- •Двойной электрический слой
- •Потенциал нулевого заряда
- •Стандартные потенциалы
- •Уравнение Нернста и направление протекания овр (термодинамика обратимых электрохимических систем)
- •Типы электродов
- •Электрохимические цепи
- •Химические цепи
- •Работа аккумулятора
- •Концентрационные цепи
- •Коррозия
- •Химическая кинетика Введение
- •Основные понятия и определения
- •Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс
- •Порядок реакции
- •Принцип независимости протекания химических реакций
- •Кинетика закрытых систем Простые реакции Односторонняя реакция первого порядка
- •Односторонние реакции второго порядка
- •Односторонние реакции третьего порядка
- •Сложные реакции
- •Двусторонние (обратимые) реакции
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Сопряженные реакции
- •Автокаталитические реакции
- •Цепные химические реакции
- •Вероятностная теория цепных реакций
- •Горение и взрыв
- •Цепной взрыв или воспламенение
- •Тепловой взрыв
- •Формальная кинетика открытых систем. Приближение формально простых и элементарных процессов
- •Модель реактора идеального смешения
- •Модель реактора идеального вытеснения
- •Влияние температуры на скорость реакции Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Теоретические основы расчета констант скорости химической реакции Теория активных столкновений
- •Теория активированного комплекса
- •О поверхности потенциальной энергии элементарного химического акта
- •О расчете скоростей элементарных реакций
- •Константа скорости реакции и термодинамические параметры активированного комплекса
- •Кинетика гетерогенных процессов
- •Уравнения Фика
- •Нестационарная диффузия Модель нестационарной линейной полубесконечной диффузии
- •Модель нестационарной сферической полубесконечной диффузии
- •Стационарная конвективная диффузия
- •Определение лимитирующей стадии (реакция или диффузия?)
- •Электролиз
- •Порядок восстановления катионов
- •Порядок окисления анионов
- •Кинетика электродных процессов (поляризация и перенапряжение)
- •Электродная поляризация
- •Диффузионное перенапряжение. Уравнение Нернста-Бруннера
- •Электрохимическое перенапряжение
- •Перенапряжение при электролитическом выделении водорода
- •Катализ
- •Основные принципы каталитического действия
- •Слитно или раздельно?
- •Кинетические уравнения каталитических реакций
- •Энергия активации каталитических реакций
- •Соотношение между эффективной и истинной энергиями активации
- •Специфичность катализа
- •Активность и селективность катализатора
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Общий кислотно-основной катализ
- •Специфический кислотно-основной катализ
- •Гетерогенный катализ Общие слова
- •Виды гетерогенных катализаторов
- •Старение и отравление катализаторов
- •Основные стадии гетерогенно-каталитического процесса
- •Закон действующих поверхностей
- •Уравнения адсорбции
- •Основные кинетические уравнения гетерогенного катализа
- •Примеры типовых схем
- •Мультиплетная теория гетерогенного катализа (а.А.Баландин)
- •Содержание
Зависимость удельной электрической проводимости растворов электролитов от концентрации
Зависимость удельной электрической проводимости растворов электролитов от концентрации показана на рис.

Зависимость удельной электропроводности растворов сильных (1) и слабых (2) электролитов от концентрации
Удельная электрическая проводимость раствора электролита определяется количеством ионов, переносящих электричество и скоростью их передвижения:
![]()
Для раствора бинарного электролита заданной концентрации:
![]()
где – степень диссоциации электролита (для разбавленных растворов сильных электролитов = 1); С – нормальная концентрация электролита, экв/л; F – число Фарадея; u+ и u– - подвижности катиона и аниона соответственно.
В разбавленных растворах сильных и слабых электролитов рост электрической проводимости с концентрацией обусловлен увеличением числа ионов, переносящих электричество. В области концентрированных растворов повышение концентрации сопровождается увеличением вязкости раствора, что снижает скорость движения ионов и электрическую проводимость. Кроме того, у слабых электролитов в концентрированных растворов заметно снижается степень диссоциации и, следовательно, число ионов, переносящих электричество.

Зависимость эквивалентной электропроводности растворов сильных (1) и слабых (2) электролитов от концентрации
Эквивалентная электропроводность связана с подвижностью иона выражением:
i = ·F·ui ,
где i – удельная электропроводность катиона либо аниона; ui - подвижность катиона либо аниона.
Отсюда значения электропроводности могут быть выражены:
![]()
и
![]() .
.
С уменьшением
концентрации раствора (увеличением
разведения) удельная электропроводность
возрастает и при
![]() стремится к предельному значению
стремится к предельному значению
![]() .
Эта величина отвечает электропроводности
гипотетического бесконечно разбавленного
раствора, характеризующегося полной
диссоциацией электролита и отсутствием
сил электростатического взаимодействия
между ионами.
.
Эта величина отвечает электропроводности
гипотетического бесконечно разбавленного
раствора, характеризующегося полной
диссоциацией электролита и отсутствием
сил электростатического взаимодействия
между ионами.
Эквивалентная электропроводность бесконечно разбавленного раствора описывается уравнением:
![]() .
.
Произведение
![]() – предельная удельная электропроводность
иона (Кольрауш). В этом случае:
– предельная удельная электропроводность
иона (Кольрауш). В этом случае:
![]()
Таким образом, предельная эквивалентная электропроводность равна сумме предельных эквивалентных электропроводностей ионов при бесконечном разбавлении (закон Кольрауша или независимого движения ионов).
Предельная эквивалентная электропроводность является специфической величиной для данного вида ионов и зависит только от природы растворителя и температуры.
Предельные эквивалентные электропроводности ионов являются справочными величинами.
Отношение эквивалентной электропроводности раствора сильного электролита к ее предельному значению ∞ называют коэффициентом электропроводности (эту величину еще называют «кажущейся степенью диссоциации»)
![]()
Отношение эквивалентной электропроводности раствора слабого электролита к ее предельному значению ∞ представляет собой степень диссоциации:
![]()
Эквивалентная электропроводность растворов электролитов зависит от двух факторов: от степени диссоциации электролита и от электрического взаимодействия между ионами.
В случае сильного электролита = 1. Изменение эквивалентной электропроводности с концентрацией обусловлено коэффициентом электропроводности f, т.е. влиянием электростатического взаимодействия ионов на скорость их движения.
Изменение эквивалентной (и молярной) электропроводности сильных электролитов в зависимости от концентрации раствора объясняется электростатическим торможением ионов (торможением движения ионов в электрическом поле). С увеличением концентрации раствора ионы сближаются и электростатическое взаимодействие между ними возрастает. Это взаимодействие идет по двум каналам: электрофоретическому и релаксационному.
Электрофоретический эффект заключается в том, что в водной среде все ионы гидратированы и под действием внешнего электрического поля движутся в разных направлениях. Таким образом, движение конкретного иона происходит как бы в среде ионов противоположного заряда, и эта среда движется в противоположном направлении.
Релаксационный эффект связан с существованием ионной атмосферы и ее влиянием на движение ионов. При перемещении под действием внешнего электрического поля центральный ион выходит из центра ионной атмосферы, которая вновь создается в новом положении иона.
С учетом релаксационного и электрофоретического эффектов
![]()
Электрофоретический
эффект:
![]()
![]()
Релаксационный
эффект:
![]()
![]()
Оба коэффициента зависят от природы растворителя и температуры.
Силы релаксационного и электрофоретического торможения определяются ионной силой раствора, природой растворителя и температурой. Для одного и того же электролита при прочих постоянных условиях эти силы возрастают с увеличением концентрации раствора.
Таким образом, на подвижность иона влияет степень гидратации ионов. Чем она больше, тем подвижность меньше. Наиболее сильно гидратируются ионы с малым радиусом и большим зарядом, например, Li, Mg, Al.
Для растворов слабых электролитов эквивалентная электропроводность зависит от концентрации электролита из-за изменения степени диссоциации. С увеличением концентрации электролита степень диссоциации уменьшается и увеличивается электростатическое взаимодействие между ионами. Это приводит к уменьшению эквивалентной электропроводности.
При небольших концентрациях зависимость эквивалентной электропроводности сильного электролита от концентрации выражается уравнением:
![]() ,
,
где а коэффициент, зависящий от природы растворителя и температуры; С – концентрация, экв/л.
Уравнение было получено экспериментально Кольраушем, а впоследствии было теоретически выведено Дебаем, Хюккелем и Онзагером.
При высоких концентрациях зависимость эквивалентной электропроводности от концентрации для бинарного электролита типа KI определяется уравнением Онзагера:
![]() ,
,
Для расчета электрической проводимости концентрированных растворов используют полуэмпирические уравнения, например, уравнение Шидловского:
![]() или
или
![]()
где D – эмпирический коэффициент.
Про электропроводность ионов H+ и OH−
Ионы Н+ (Н3О+) и ОН− обладают более высокой эквивалентной электропроводностью, чем другие ионы.
Для сравнения:
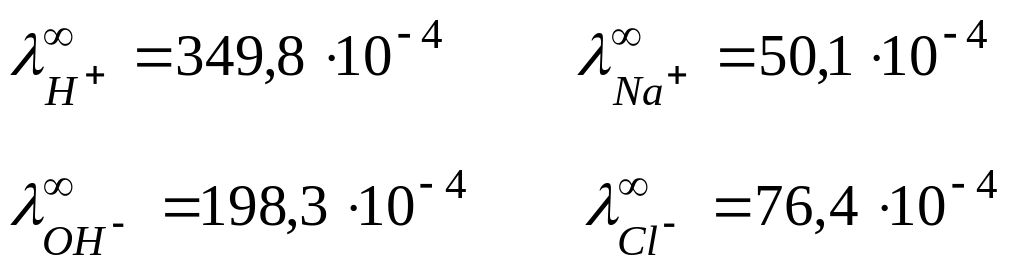 См∙м2/моль
См∙м2/моль
На текущий момент времени принято считать, что перемещение ионов H+ и ОН− по объему воды обеспечивается сразу двумя механизмами: миграция, как для других ионов, + т.н. эстафетный механизм.
Сущность эстафетного механизма:
Ионы Н3О+ обмениваются протонами с соседними молекулами вода, причем этот обмен в отсутствие электрического поля вероятен в любом направлении. При наложении электрического поля вероятность перехода протона от иона гидроксония к молекуле воды повышается в направлении поля. Передвижение протона по цепочке от одной молекулы воды к другой можно представить в виде схемы:
направление поля →

направление движения протона и Н3О+ →
Для осуществления эстафетного механизма молекулы воды должны быть ориентированы друг относительно друга.
Аналогично идет эстафета для иона гидроксида за счет передачи протона от молекулы воды к иону OH−:
направление поля →

направление движения протона →
←направление перемещения ОН−
Т.к. энергия отрыва
протона от молекулы воды больше, чем от
иона гидроксония, то вероятность перехода
протона от Н2О к ОН− меньше,
чем от Н3О+ к Н2О.
Следовательно,
![]()
