
- •Государственное образовательное учреждение высшего профессионального образования Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
- •Конспект лекций физическая химия
- •Введение
- •Физическая химия
- •Термодинамика Введение Историческая справка
- •Задачи термодинамики
- •Понятия и определения
- •Внутренняя энергия системы
- •Теплота и работа
- •Первый закон термодинамики
- •Применение первого закона термодинамики к процессам в идеальных газах
- •Теплоемкость
- •Приближенные правила расчета теплоемкости
- •Зависимость теплоемкости от температуры
- •Теории теплоемкости Классическая кинетическая теория
- •Теория теплоемкости Эйнштейна-Дебая (квантовая теория) для твердого вещества 1907 г
- •Усовершенствования в теорию Эйнштейна внес Дебай
- •Квантовостатистическая теория газов
- •Тепловые эффекты химических реакций Закон Гесса. Вычисление теплового эффекта химической реакции при обычных условиях
- •Вычисление теплового эффекта методом алгебраического суммирования термохимических уравнений
- •Вычисление теплового эффекта графическим методом (методом термохимических схем)
- •Вычисление теплового эффекта по стандартным энтальпиям образования
- •Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования
- •Вычисление теплового эффекта по стандартным энтальпиям сгорания
- •Вычисления общего количества теплоты, необходимого для нагревания вещества
- •Зависимость теплового эффекта реакции от температуры
- •Второй закон термодинамики. Энтропия
- •Определение энтропии по Больцману (термодинамическая вероятность)
- •Изменение энтропии в некоторых процессах
- •Изменение энтропии при фазовых превращениях
- •Изменение энтропии при изотермическом расширении (сжатии) 1 моль идеального газа
- •Изменение энтропии при нагревании системы
- •Изменение энтропии при кристаллизации переохлажденной жидкости
- •Изменение энтропии химической реакции
- •Изменение энтропии идеального газа
- •Термодинамические потенциалы
- •Характеристические функции
- •Уравнения Гиббса-Гельмгольца
- •Третий закон термодинамики
- •Парциальные молярные величины
- •Уравнения Гиббса-Дюгема
- •Следствия из уравнений Гиббса-Дюгема
- •Относительные пм свойства
- •Кажущиеся молярные величины
- •Методы определения парциальных молярных величин
- •Химический потенциал
- •Зависимость химического потенциала от температуры
- •Химический потенциал в газах
- •Химический потенциал в растворах
- •Химическое равновесие Константа равновесия. Закон действующих масс
- •Использование закона действующих масс для расчета состава равновесной газовой смеси
- •Уравнение изотермы химической реакции (влияние состава на равновесие)
- •Принцип Ле-Шателье и влияние различных факторов на химическое равновесие
- •Уравнение изобары химической реакции
- •Метод приведенных энергий Гиббса Метод Темкина-Шварцмана Равновесие в гетерогенной системе
- •Условие равновесия в гетерогенной системе
- •Константа равновесия гетерогенной системы
- •Фазовые равновесия Основные понятия и определения
- •Правило фаз Гиббса
- •Уравнение Клаузиуса-Клапейрона
- •Применение уравнения Клаузиуса-Клапейрона к различным процессам
- •Равновесия с участием растворов
- •Термодинамические условия образования растворов
- •Закон Рауля
- •Растворимость газов
- •Растворимость твердых веществ. Уравнение Шредера
- •Зависимость растворимости твердых веществ от давления
- •Температура кипения раствора
- •Температура замерзания раствора
- •Осмотическое давление
- •Фазовые диаграммы Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные неконденсированные системы
- •Двухкомпонентные конденсированные системы Построение диаграмм
- •Типовые диаграммы состояния конденсированных систем
- •Трехкомпонентные конденсированные системы
- •Треугольник Гиббса
- •Метод Розебума
- •Правило луча
- •Сечения объемной диаграммы
- •Проекция нескольких сечений
- •Диаграмма состояния трехкомпонентной конденсированной системы без химических соединений и фазовых превращений
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся без разложения
- •Диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся с разложением
- •Компоненты системы образуют одно тройное химическое соединение s с конгруэнтной точкой плавления.
- •Водно-солевые системы
- •Диаграмма состояния трехкомпонентной водно-солевой системы без кристаллогидратов и двойных солей
- •Диаграмма растворимости двух солей с одноименным ионом в случае образования двойной соли
- •Кристаллизация соли ах сопровождается связыванием определенного количества кристаллизационной воды с образованием кристаллогидрата
- •Кристаллизация соли ах сопровождается появлением двойной соли с образованием кристаллогидрата этой двойной соли
- •Электрохимия Введение
- •Историческая справка о науке электрохимии
- •Растворы электролитов Основные понятия и определения
- •Историческая справка о природе растворов электролитов
- •О сольватации и ассоциации Ассоциация
- •Сольватация
- •Термохимическая теория растворения электролитов
- •Теория гидратации Борна
- •Метод активностей
- •Теория Дебая-Хюккеля
- •Электрическая проводимость растворов Введение
- •Зависимость электропроводности от температуры
- •Движение ионов в электрическом поле. Числа переноса ионов
- •Зависимость удельной электрической проводимости растворов электролитов от концентрации
- •Метод кондуктометрии
- •Термодинамика электродных систем Введение
- •Закон Фарадея
- •Электроды, цепи, их схематическая запись
- •Правила записи электродов и цепей
- •Возникновение скачка потенциала на границе раствор-металл
- •Двойной электрический слой
- •Потенциал нулевого заряда
- •Стандартные потенциалы
- •Уравнение Нернста и направление протекания овр (термодинамика обратимых электрохимических систем)
- •Типы электродов
- •Электрохимические цепи
- •Химические цепи
- •Работа аккумулятора
- •Концентрационные цепи
- •Коррозия
- •Химическая кинетика Введение
- •Основные понятия и определения
- •Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс
- •Порядок реакции
- •Принцип независимости протекания химических реакций
- •Кинетика закрытых систем Простые реакции Односторонняя реакция первого порядка
- •Односторонние реакции второго порядка
- •Односторонние реакции третьего порядка
- •Сложные реакции
- •Двусторонние (обратимые) реакции
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Сопряженные реакции
- •Автокаталитические реакции
- •Цепные химические реакции
- •Вероятностная теория цепных реакций
- •Горение и взрыв
- •Цепной взрыв или воспламенение
- •Тепловой взрыв
- •Формальная кинетика открытых систем. Приближение формально простых и элементарных процессов
- •Модель реактора идеального смешения
- •Модель реактора идеального вытеснения
- •Влияние температуры на скорость реакции Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Теоретические основы расчета констант скорости химической реакции Теория активных столкновений
- •Теория активированного комплекса
- •О поверхности потенциальной энергии элементарного химического акта
- •О расчете скоростей элементарных реакций
- •Константа скорости реакции и термодинамические параметры активированного комплекса
- •Кинетика гетерогенных процессов
- •Уравнения Фика
- •Нестационарная диффузия Модель нестационарной линейной полубесконечной диффузии
- •Модель нестационарной сферической полубесконечной диффузии
- •Стационарная конвективная диффузия
- •Определение лимитирующей стадии (реакция или диффузия?)
- •Электролиз
- •Порядок восстановления катионов
- •Порядок окисления анионов
- •Кинетика электродных процессов (поляризация и перенапряжение)
- •Электродная поляризация
- •Диффузионное перенапряжение. Уравнение Нернста-Бруннера
- •Электрохимическое перенапряжение
- •Перенапряжение при электролитическом выделении водорода
- •Катализ
- •Основные принципы каталитического действия
- •Слитно или раздельно?
- •Кинетические уравнения каталитических реакций
- •Энергия активации каталитических реакций
- •Соотношение между эффективной и истинной энергиями активации
- •Специфичность катализа
- •Активность и селективность катализатора
- •Гомогенный катализ
- •Кислотно-основной катализ
- •Общий кислотно-основной катализ
- •Специфический кислотно-основной катализ
- •Гетерогенный катализ Общие слова
- •Виды гетерогенных катализаторов
- •Старение и отравление катализаторов
- •Основные стадии гетерогенно-каталитического процесса
- •Закон действующих поверхностей
- •Уравнения адсорбции
- •Основные кинетические уравнения гетерогенного катализа
- •Примеры типовых схем
- •Мультиплетная теория гетерогенного катализа (а.А.Баландин)
- •Содержание
Изменение энтропии при кристаллизации переохлажденной жидкости
Здесь рассматривается
неравновесный процесс:
![]() ,
который моделируется в квазиравновесный,
путем разбивания на стадии.
,
который моделируется в квазиравновесный,
путем разбивания на стадии.
1. Нагревание жидкости до точки плавления
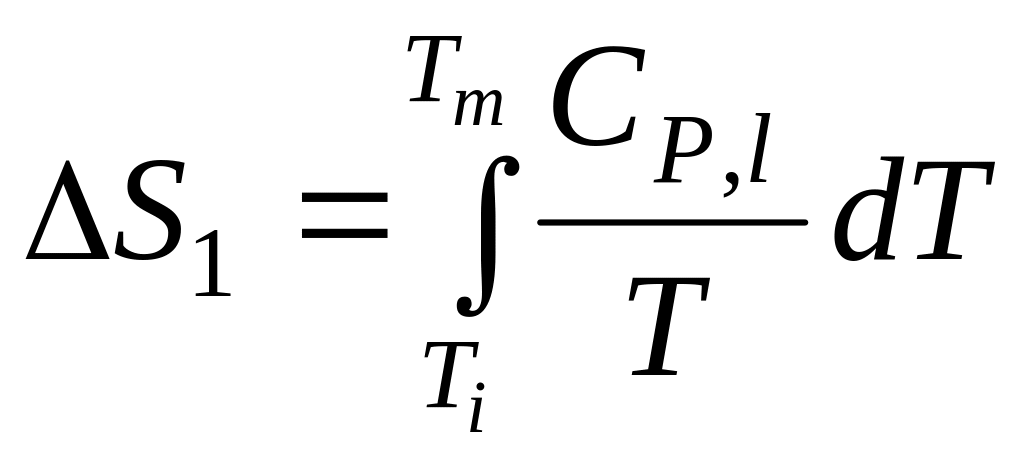
2. Кристаллизация жидкости при температуре плавления Tm
![]()
3. Охлаждение твердого вещества от Tm до Ti
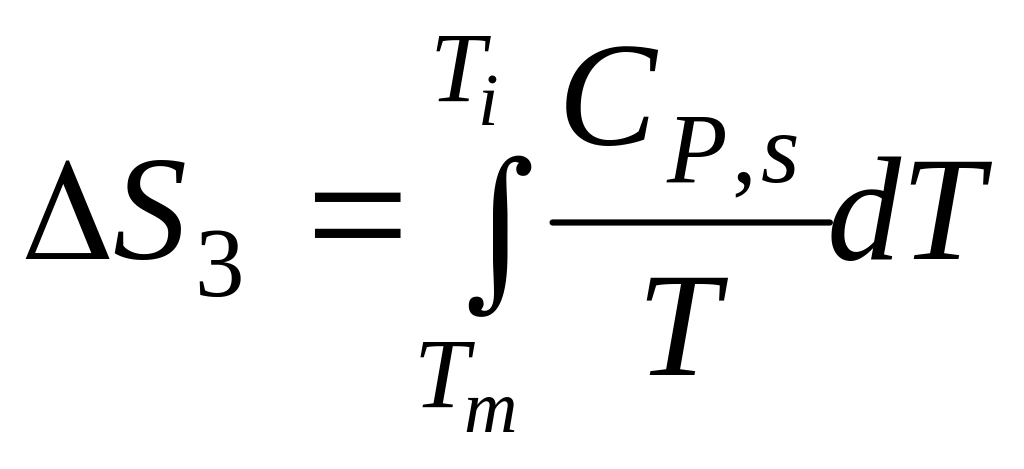
Итого:

Изменение энтропии химической реакции
В силу того, что энтропия – функция состояния, то к ней применим закон Гесса:
![]() ,
,
где ν –
стехиометрический коэффициент; индекс
i относится к исходным
веществам, индекс k –
к продуктам реакции.
![]() – энтропия образования вещества,
приведенная к стандартным условиям при
температуре Т.
– энтропия образования вещества,
приведенная к стандартным условиям при
температуре Т.
Зависимость
изменения энтропии химической реакции
от температуры описывается уравнением:
![]() .
.
Изменение энтропии идеального газа
Выводится из уравнения, объединяющего I и II законы термодинамики:
![]()
Или
![]()
Откуда
![]()
Если считать, что теплоемкость не зависит от температуры, то после интегрирования:

Эти уравнения позволяют рассчитывать изменение энтропии 1 моль идеального газа при переменных T, V и P.
Для изотермического расширения ИГ
![]()
Для изохорного или изобарного нагревания

Для образования 1 моль смеси идеальных газов
![]()
Для смеси из двух газов:
![]()
Термодинамические потенциалы
Из уравнения I
и II начал термодинамики
![]() выводится, что для изолированных систем
критерием самопроизвольности протекания
процесса является изменение энтропии:
dS > 0. Для состояния
равновесия в изолированной системе
нужно выполнение условия dS
= 0.
выводится, что для изолированных систем
критерием самопроизвольности протекания
процесса является изменение энтропии:
dS > 0. Для состояния
равновесия в изолированной системе
нужно выполнение условия dS
= 0.
На практике используются системы закрытые либо открытые. Следовательно, необходим вывод критерия, который бы отвечал двум требованиям:
1) позволял прогнозировать направление протекания процесса в любых условиях его проведения;
2) его можно было вычислить исходя из термодинамических характеристик системы.
В качестве подобного критерия была разработана система термодинамических потенциалов (Гиббс, Гельмгольц, Дюгем).
Термодинамический потенциал – максимальная работа, которую может совершить система при обратимом протекании процесса в данных условиях.
Тогда если система
совершает по ходу процесса работу,
меньшую, чем максимальная, то такой
процесс идет самопроизвольно:
![]() или
состояние равновесия
или
состояние равновесия
![]()
Объединенное уравнение первого и второго законов термодинамики можно записать в виде
для простой системы
![]()
для сложной системы
![]()
В простой системе осуществляются обратимые процессы:
В сложной системе
осуществляются обратимые процессы:
![]()
Для систем, единственным видом работы которых является работа расширения (простые системы) четыре вида условий взаимодействия системы с окружающей средой:

Ситуация V,S = const
Объединенное
уравнение первого и второго законов
термодинамики для простой системы:
![]()
Очевидно, что для
протекания процесса необходимо условие
![]() ,
а для равновесия
.
,
а для равновесия
.
В данном случае внутренняя энергия будет термодинамическим потенциалом (изохорно-изоэнтропийным) и критерием возможности самопроизвольности протекания процесса.
Ситуация Р,S = const
Согласно
преобразованию Лежандра
![]()
Для простых систем
![]()
Тогда уравнение
можно
преобразовать к виду
![]()
Очевидно, что для
протекания процесса необходимо условие
![]() ,
а для равновесия
,
а для равновесия
![]() .
.
В данном случае энтальпия будет термодинамическим потенциалом (изобарно-изоэнтропийным) и критерием возможности самопроизвольности протекания процесса.
Ситуация V,T = const
![]()
![]()
Термодинамическая функция F=U – TS называется функцией Гелъмголъца, или изохорно-изотермическим потенциалом. Поскольку эта функция образована из функций состояния U и S, она также является функцией состояния.
Очевидно, что для
протекания процесса необходимо условие
![]() ,
а для равновесия
,
а для равновесия
![]() .
.
Таким образом с приближением системы к состоянию равновесия изохорно-изотермический потенциал убывает, достигая минимума в состоянии равновесия.
Ситуация Р,T = const
Р,T = const, следовательно W = 0.
![]()
![]()
![]()
![]()
Термодинамическая функция G = H – TS называется функцией Гиббса, или изобарно-изотермическим потенциалом. Поскольку эта функция образована из функций состояния U и S, она также является функцией состояния.
Очевидно, что для
протекания процесса необходимо условие
![]() ,
а для равновесия
,
а для равновесия
![]() .
.
Для сложных систем в перечисленных ситуациях критерии самопроизвольности протекания процесса те же самые. Преобразования уравнения приведут к следующим результатам.
V,S = const
![]()
В состоянии
равновесия работа равна убыли внутренней
энергии
![]()
V,T = const
![]()
В состоянии
равновесия работа равна убыли энтальпии
![]()
V,T = const
![]()
В состоянии
равновесия работа равна убыли энергии
Гельмгольца
![]()
Р,T = const
![]()
В состоянии
равновесия работа равна убыли энергии
Гиббса
![]()
Функции U, H, F, G называются характеристическими.
Работа, которая может быть совершена сложной системой при данных условиях взаимодействия с окружающей средой (за вычетом работы расширения), равна убыли соответствующих характеристических функций. Поскольку в состоянии равновесия работа, совершенная системой, максимальна при определенных внешних условиях, по этой причине характеристические функции U, И, F, G называют термодинамическими потенциалами.
