
Гидрат аммиака
Гидра́т аммиа́ка (гидрокси́д аммо́ния, аммиа́чная вода́, едкий аммоний, едкий аммиак) — соединение, образующееся при взаимодействии аммиака с водой и диссоциирующее в воде с образованием катионов аммония и гидроксид-анионов (слабое основание):
NH3 + H2O = NH3·H2O = NH4+ + OH−
Имеет щелочную среду
Реакция образования гидроксида аммония обратима, поэтому в водных растворах гидроксид аммония находится в равновесии с аммиаком, обусловливающим резкий запах таких растворов.
Водные растворы аммиака, в которых он существует преимущественно в форме гидроксида аммония, носят название аммиачная вода (промышленно выпускается 25%-й раствор аммиака, получают насыщением синтетическим газообразным аммиаком воды или аммиаком, образующимся при коксовании каменных углей в коксовых печах).
Применение
Аммиачная вода применяется для получения солей аммония (азотные удобрения), в производстве соды, красителей и др., слабый (обычно 10%-й) раствор — нашатырный спирт.
Комплексообразование
Благодаря своим электронодонорным свойствам, молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
![]()
![]()
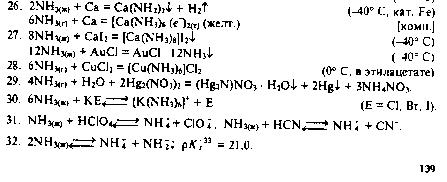
Комплексообразование обычно сопровождается изменением окраски раствора. Так, в первой реакции голубой цвет (CuSO4) переходит в темно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO3)2) в сине-фиолетовую. Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявлется его сходство с водой:
![]()
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов.
При испарении аммиака щелочные металлы выделяются в чистом виде
6NaNH2 = 6Na + 4NH3 + N2
а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6] обладающих металлической проводимостью.
[реакция]
При слабом нагревании эти комплексы разлагаются на металл и NH3.
[реакция]
Растворенный в NH3 металл постепенно реагирует с образованием амида:
![]()
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Гидразин n-2
N2H4
Физические и хим.св-ва:
Бесцв. дымящая на воздухе жидкость с неприятным запахом. Вызывает рак и мужское бесплодие. Хорошо растворим в воде. Кривая молекула

Способ получения:
Процесс Рашига. Гидразин получают окислением аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO:
NH3
+ NaClO
![]() NH2Cl
+ NaOH
NH2Cl
+ NaOH
NH2Cl + NH3 N2H4+ HCl,
Химические с-ва и сравнение с аммиаком:
Термодинамически гидразин значительно менее устойчив, чем аммиак, так как связь N—N не очень прочна: разложение гидразина - экзотермическая реакция, протекающая в отсутствие катализаторов при 200-300 °С:
3N2H4 → 4NH3 + N2
горит:
N2H4+O2=N2+2H2O+Q
Переходные металлы (Co, Ni, Cu, Ag) катализируют разложение гидразина, при катализе платиной, родием и палладием основными продуктами разложения являются азот и водород:
N2H4 → N2 + 2H2
Благодаря наличию двух неподелённых пар электронов у атомов азота, гидразин способен к присоединению одного или двух ионов водорода. При присоединении одного протона получаются соединения гидразиния с зарядом 1+, двух протонов — гидразиния 2+, содержащие соответственно ионы N2H5+ и N2H62+. Водные растворы гидразина обладают основными свойствами, но его основность значительно меньше, чем у аммиака:
N2H4 + H2O → [N2H5]+ + OH− (Kb = 3,0·10−6)
(для аммиака Kb = 1,78·10−5) Протонирование второй неподеленной пары электронов протекает ещё труднее:
[N2H5]+ + H2O → [N2H6]2+ + OH− (Kb = 8,4·10−16)
Известны соли гидразина — хлорид гидразиния N2H5Cl, сульфат гидразиния N2H6SO4 и т. д. Иногда их формулы записывают N2H4 · HCl, N2H4 · H2SO4 и т. д. и называют гидрохлорид гидразина, сульфат гидразина и т. д. Большинство таких солей растворимо в воде.
Соли гидразина бесцветны, почти все хорошо растворимы в воде. К числу важнейших относится сульфат гидразина N2H4 · H2SO4.
Общ. сравнение:
1.менее основный
2.Одинаковые продукты горения
3.Два раза реагирует с к-тами
4.Легко горит
Ещё хим. св-ва:
Гидразин — энергичный восстановитель. В растворах гидразин обычно также окисляется до азота:
4KMnO4 + 5N2H4 + 6 H2SO4 → 5N2 + 4MnSO4 + 2K2SO4 + 16H2O
Восстановить гидразин до аммиака можно только сильными восстановителями, такими, как Sn2+, Ti3+, водородом в момент выделения(Zn + HCl):
N2H4 + Zn + 4HCl → 2NH4Cl + ZnCl2
