
- •Текст лекций по курсу: «Металлургия редких металлов»
- •4.1 История открытия галлия, индия и таллия
- •2.2 Химические свойства галлия, индия и таллия, а также их важнейших химических соединений
- •4.3 Применение галлия, индия и таллия и их соединений
- •4.3.1. Применение галлия
- •4.3.2 Применение индия
- •4.3.3 Применение таллия
- •4.4 Сырьевые источники галлия, индия и таллия
- •4.5 Поведение галлия, индия и таллия при переработке минерального сырья
- •4.5.1 Поведение галлия
- •4.5.2 Поведение индия
- •4.5.3 Поведение таллия
- •4.6 Технология получения первичных соединений галлия, индия и таллия
- •4.6.1 Производство галлия
- •4.6.2 Производство индия
- •4.7 Технология получения металлических галлия и индия
- •4.8 Литература по металлургии галлия, индия и таллия
4.6 Технология получения первичных соединений галлия, индия и таллия
4.6.1 Производство галлия
В промышленности получают два типа растворов, содержащих галлий:
– щелочные (глиноземное производство);
– кислые, преимущественно солянокислые.
Для предварительного обогащения их галлием используют способы: известковый, экстракции и сорбции как из кислых, так и из щелочных растворов.
Известковый метод в сочетании с карбонизацией часто применяется при переработки поташных маточников, получающихся в технологии нефелина (рисунок 4.3). Преимущества этого способа заключаются в органическом сочетании технологии извлечения галлия и основного производства глинозема. При его осуществлении получают товарные продукты — соду и поташ, возвратные промпродукты — гидроксид алюминия, алюминатный раствор, карбонат кальция. Способ позволяет получить щелочной раствор, очищенный от примесей, пригодный для получения металлического галлия. К числу недостатков нужно отнести многостадийность, необходимость очень точного регулирования технологических операций как по составу реагентов, так и режиму.
На переработку поступает маточник после карбонизации, содержащий 0,019—0,020 г/л Ga2О3. Маточник упаривают, затем охлаждают для кристаллизации соды, которая хуже растворяется в воде и водных растворах, чем поташ. Например, при 20 °С их растворимость в воде соответственно равна 17,8 и 52,8%. После кристаллизации соды маточник снова упаривают, охлаждают, выделяют поташ.
Далее маточник направляется на первую карбонизацию с введением зародышей А1(ОН)3 и медленным перемешиванием; целью ее является получение возможно более чистого осадка гидроксида алюминия, который возвращается в основной производственный цикл. На карбонизацию поступает маточник, содержащий 32–38 г/л А12О3. В осадок выделяют ~80% алюминия, остаточная концентрация его в растворе 8–10 г/л. Потери галлия составляют ~10% от поступившего.
Следующей операцией является обработка маточника известковым молоком, при которой частично удаляются некоторые примеси, в том числе крайне нежелательные: железо, кремний и др. Удаление примесей происходит за счет химического взаимодействия, изоморфизма и сорбции их на осадке СаСО3. Кроме того, происходит каустификация раствора, протекающая по реакции:
Na(K)2CО3 + Са(ОН)2 → 2Na(K)OH + СаСО3.
Этот процесс имеет большое значение для последующего выделения галлия из растворов электролизом или цементацией, которые проводятся в чисто щелочных растворах. В осадке карбоната кальция содержится, %: 48–49 СаО; 1–1,5 SiO2; 0,70 Fe2О3; 1,0 MgO; 0,38 А12О3; 0,0001 Ga.
Маточник направляют на 2-ю карбонизацию, задачей которой является выделение в осадок алюминия и галлия, т.е . должно быть достигнуто наиболее полное соосаждение галлия с алюминием из растворов, в которых растворимость галлия довольно велика.. Задача второй (глубокой) карбонизации прямо противоположна первой; лучшие результаты могут быть получены при проведении ее в условиях, наиболее далеких от равновесных. Оптимальным оказалось наиболее быстрое ее проведение путем сливания алюминатного и гидрокарбонатного растворов. При этом образуется объемистый осадок гид-роксокарбонатов алюминия и галлия и гидроксида алюминия. Несмотря на высокую растворимость в результате изоморфного замещения и сорбции на быстро образующемся осадке в него переходит 95–97% галлия. По сути дела — это осаждение микрокомпонента на носителе. Примеси в оксогидроксокарбонате алюминия, %: 0,4 SiО2; 0,06 Fe2О3.
Осадок, полученный при карбонизации, обрабатывают небольшим количеством известкового молока при 90–95 °С. В таком растворе заметно растворяется только Ga(OH)3, алюминий почти полностью остается в осадке. Дальнейшее добавление Са(ОН)2 приводит к каустификации раствора. В нем происходит растворение и галлия и алюминия. При соотношении CaO:CО2 = 1 : 1 процесс заканчивается, в раствор переходит 30—40% алюминия и 85–95% галлия. В результате этой операции раствор обогащается галлием в 2–3 раза.
После растворения (разложения) осадка раствор направляют на очистку от примесей, для чего используют два метода: метод восстановления и сорбции, а чаще оба способа одновременно. Восстановление проводят порошком алюминия или другими реагентами тех примесей, соединения которых в низших степенях окисления плохо растворяются в щелочных растворах, например: железо, ванадий, хром. Сорбцию проводят на неорганических сорбентах, не растворяющихся в щелочных растворах: пиролюзит, Mg(OH)2, Са(ОН)2 и др. После очистки от примесей в растворе корректируют концентрацию щелочи до значения, необходимого при проведении цементации или электролиза (5 моль/л КОН). Раствор содержит до 1,5 г/л галлия.
Кроме рассмотренных процессов с участием Са(ОН)2 и СаО можно выделить из щелочных растворов трехкальциевый алюминат по реакции (75°С):
2Na[AI(OH)4] + ЗСа(ОН)2 → 3СаО·А12О3·6Н2О + 2NaOH
Растворимость трехкальциевого галлата Ca3[Ga(OH)6]2·хН2О в пересчете на Ga2О3 ~8 г/л. Обычно в растворах концентрация его меньше, поэтому в осадке алюмината он оказывается только в результате соосаждения, осаждается же ~85% алюминия и 10–12% галлия. В растворе при этом отношение Ga : А1 увеличивается в 6–7 раз. На эту операцию могут поступать и алюминатные растворы, полученные по способу Байера.
Извлечение галлия из растворов экстракцией
Для извлечения галлия из растворов в зависимости от его ионного состояния используют экстрагенты различных классов. Наибольшее изучена экстракция галлия из солянокислых растворов нейтральными экстрагентами. Галлий извлекается ими по сольватному механизму в виде комплексов GaCl3· nS или при высоких концентрациях соляной кислоты — по гидратно-сольватному в виде [H(H2О)mSn]GaCl4.
В России и за рубежом в промышленности галлий экстрагируют преимущественно из солянокислых растворов. Из растворов в других минеральных кислотах галлий экстрагируется очень плохо Для этой цели используется только трибутилфосфат. При экстракции из солянокислых растворов коэффициент распределения галлия (D) увеличивается при повышении концентрации НС1.
Введение в раствор других кислот (соляной в количестве, немного превышающем необходимое для образования HGaCl4), увеличивает коэффициенты распределения на несколько порядков. При этом экстрагируются чисто хлоридные комплексы, смешанные комплексы не образуются. В системе, имеющей наибольшее практическое значение H2SО4—НС1, замена части соляной кислоты на серную не снижает извлечения галлия и удешевляет технологический процесс. При экстракции из сернокислых растворов в промышленности необходимую концентрацию ионов СГ получают добавлением NaCl.
Для регулирования технологических свойств органической фазы (плотности, вязкости, поверхностного натяжения), влияющих на кинетику диффузионного переноса вещества из одной фазы в другую и скорость расслаивания фаз, в экстракционных процессах используют растворы экстрагентов в органических жидких веществах, которые сами не взаимодействуют с экстрагируемым веществом, но позволяют улучшить физико-химические свойства раствора. В промышленности в качестве такого растворителя (разбавителя) используют керосин.
Алюминий, не имеющий d-электронов, в отличие от Ga и In обладает малой способностью к комплексообразованию. Это свойство особенно характерно при взаимодействии алюминия с лигандами — слабыми комплексообразователями, к числу которых относятся ионы хлорид и нитрат. В результате при экстракции в присутствии соляной кислоты коэффициент распределения алюминия на много порядков меньше, чем для галлия. Вследствие этого хлорид и нитрат алюминия Достаточно широко используются в качестве высаливателей при экстракции многих элементов.
В технологических растворах кроме алюминия и галлия присутствуют и многие другие примеси (Fe, As, Сu, Zn и др.). Концентрации некоторых из них могут быть во много раз больше концентрации галлия. Одной из таких примесей является железо, которое может присутствовать в виде Fe(III), Fe(II) и их смесей. Железо(III) образует в солянокислых растворах комплексы HFeCl4 того же типа, что и HGaCl4; это в значительной степени определяет сходство их поведения при экстракции. Железо (II) в отличие от железа (III) экстрагируется плохо. При совместной экстракции с галлием FeCl2 действует как высаливатель. Для восстановления Fe(III) могут быть использованы железный скрап, стружка, порошки железа и алюминия и др.
Экстракция примесей, не отличающихся склонностью к образованию устойчивых хлорметаллатных комплексов (Ni, Mg, Са и др.), подавляется в присутствии больших концентраций хорошо экстрагирующимся железом(III). Крайне нежелательной примесью является мышьяк, присутствующий в растворах в виде As(III) и As(V). Из растворов с концентрацией НС1 > 6 моль/л и 0,13 г/л As хорошо экстрагируется AsCl3.
В качестве примера рассмотрим извлечение галлия экстракцией ТБФ при переработке зольных уносов выщелачиванием серной и соляной кислотами (рисунок 4.4). Зольные уносы, образующиеся при газификации и сжигании каменных углей, содержат галлия от 50 до 350 г/т. Их выщелачивают серной кислотой (~8 моль/л) при 120°С в течение 2 ч; при этом в раствор переводится до 96% галлия. Из макрокомпонентов переходят в раствор Al, Fe, Mg, Ti и микрокомпоненты Zn, Pb, Cd, Mo, Cu, As, Ge, Sb.
Экстракцию проводят 15%-ным раствором ТБФ в керосине, что Уменьшает его потери с водной фазой и улучшает очистку от примесей. Для экстракции раствор разбавляют соляной кислотой так, чтобы концентрация серной и соляной кислот составляла, соответственно ~4 и ~1,5 моль/л. Концентрация галлия в растворе от 10 до 80 мг/л (в среднем 30 мг/л). В результате однократной экстракции в органическую фазу извлекается 95—98% галлия. Из макрокомпонентов только железо переходит в экстракт в большом количестве, его концентрация в органической фазе— до 1,3 моль/л. Хорошо экстрагирующееся железо подавляет экстракцию микрокомпонентов, практически из них в экстракте присутствуют только As и Ge.
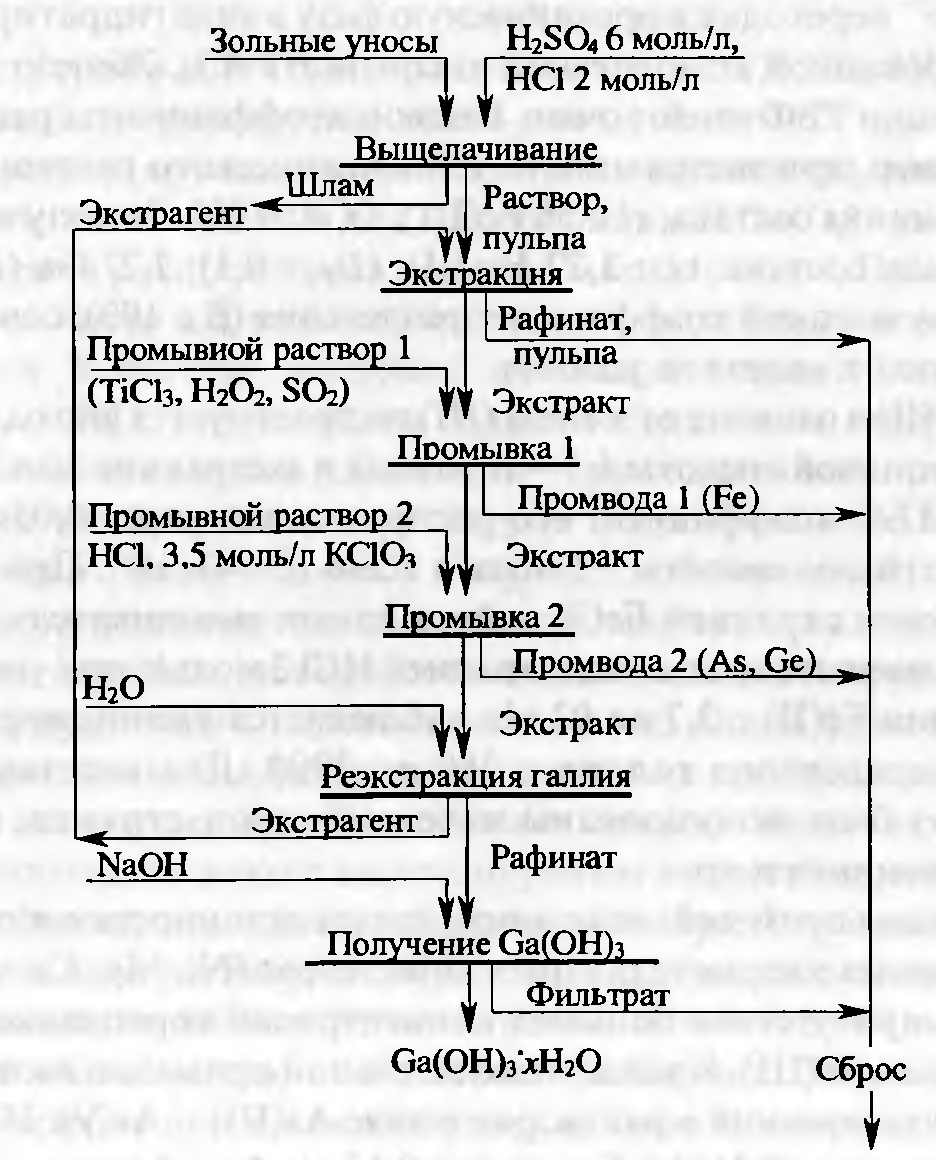
Рисунок 4.4 — Принципиальная схема извлечения галлия при переработке зольных уносов сжигания каменных углей.
Удаление из экстракта Fe, As и Ge достигается на стадии промывки. Первым удаляется железо промывкой экстракта селективным растворителем, содержащим восстановители (TiCl3 или Н2О2). В результате однократной промывки удаляется 99,9% железа. Для удаления мышьяка экстракт промывают соляной кислотой концентрацией 3,5 моль/л, содержащей окислитель, например КСlO3. За одну ступень удаляется более 90% мышьяка. Вместе с мышьяком удаляется и большая часть германия. Выделение галлия из экстракта осуществляется реэкстракцией водой при О:В > 1, что позволяет повысить концентрацию галлия в реэкстракте. Из реэкстракта можно получить электролизом металлический галлий или осадить гидроксид, в который извлекается до 85% галлия.
Извлечение галлия сорбцией. При низких концентрациях (< 30 мг/л) для извлечения галлия более эффективными могут оказаться сорбционные процессы из-за значительных потерь экстрагента. Для этих целей могут использоваться ионообменные материалы различных типов. Сорбцию галлия из солянокислых растворов, получаемых при кислотном растворении анодных сплавов, проводят на высокоосновном анионите АВ-16 или на низкоосновном АН-31. Сорбцию осуществляют из растворов с концентрацией соляной кислоты 3,7 моль/л. Поскольку Fe(III) сорбируется вместе с галлием, его предварительно восстанавливают. После сорбции анионит промывают НС1 5 моль/л и десорбируют галлий соляной кислотой той же концентрации. Достигается почти полное отделение галлия от алюминия, но сорбционная емкость анионитов по галлию мала (~2 мг/г). Заслуживает внимания сорбция галлия на неорганических ионообменниках, регенерация которых часто не требуется. В качестве таких сорбентов могут использоваться высокодисперсные порошки неорганических соединений, не разлагающихся в растворах, из которых проводится сорбция. Одним из таких материалов является активный диоксид марганца, который сорбирует галлий из растворов с рН ~2,0.
