
- •Хроматографические методы анализа
- •3.1. Хроматографические параметры
- •4. Качественный и количественный анализ в хроматографии
- •5. Основные узлы приборов для хроматографического анализа
- •6. Газовая и газожидкостная хроматография
- •7. Жидкостная хроматография
- •8. Адсорбционная вэжх
- •9. Ионная хроматография
- •10. Тонкослойная хроматография (тсх)
10. Тонкослойная хроматография (тсх)
В TСХ неподвижная твердая фаза тонким слоем наносится на стеклянную металлическую или пластмассовую пластину. В 2-х - 3-х см от края пластины проводят стартовую линию простым карандашом и на нее наносят анализируюмую пробу жидкости, затем край пластины опускают в растворитель, который действует как подвижная фаза в ЖАХ. Под действием капиллярных сил растворитель движется вдоль слоя сорбента и с разной скоростью переносит компоненты анализируемой смеси, что приводит к их пространственному разделению. Диффузия растворителя идет в продольном и поперечном направлениях, поэтому процесс рассматривается как двумерный. В качестве сорбентов используют Al2O3, SiО2, полимерные полиамидные порошки, имеющие малые размеры.

hх – расстояние от стартовой линии до центра хроматографического пятна.
hp – расстояние от стартовой линии до фронта растворителя.
Сорбционные свойства системы в ТСХ характеризуется подвижностью Rx, которая рассчитывается из экспериментальных данных по уравнению (1).
Т.к. на подвижность (Rx) влияет качество сорбента, его активность, влажность, толщина, качество растворителя и другие факторы, неподдающиеся контролю, на практике пользуются относительной величиной Rх отн
Rx oтн = Rx/Rст
Эта величина не зависит от индивидуальных характеристик хроматографической пластины.
Выбор растворителя зависит от природы сорбента и свойств анализируемого вещества, используя часто смеси растворителя.
Методом ТСХ можно анализировать как неорганические соединения (ионы), так и органические соединения. Возможность анализа не зависит от летучести веществ, анализ идет при комнатной температуре. Качественный анализ осуществляется по значениям Rх, если анализ проводят в стандартных условиях можно воспользоваться табличными данными, где даются значения Rx веществ различных на тех или других сорбентах. Могут использовать для идентификации анализируемых веществ известные вещества, нанося их вместе с анализируемым веществом на пластину – метод свидетеля.
После окончания хроматографирования зоны на храматограмме проявляют физическими или химическими методами. При химическом способе пластину опрыскивают раствором реактива, взаимодействующего с компонентами и смеси и дающего характерную окраску. Непредельные соединения определяют, выдерживая пластины в парах йода. При физическом методе проявления используется способность некоторых веществ флуоресцировать под действием УФ-облучения часто добавляют реагенты, способные к флуоресценции.
Количественный анализ с использованием ТСК осуществляют измеряя площадь пятна и используя градуировочный график, построенный в координатах S – 1gC . Или можно соскоблить пятно, проэкстрагировать анализируемое вещество из порошка- носителя и проанализировать экстракт любыми доступными Ф/Х методами анализа.
Распределительная хроматография на бумаге сходна с ТСХ. Отличие: в использовании в качестве носителя спец. хром, бумаги. Также как в ТСХ используют фильтровальную бумагу.
Очень эффективным является сочетание хроматографии и электрофореза, т.е. получение электрофоретической хроматограммы на бумаге. Воздействие электрического; поля можно использовать одновременно с хроматографированием или последовательно (сначала электрофорез, а затем хроматографирование).
11. Масс-спектроскопия - основы метода. Масс-спектры и их характеристика, использование для анализа загрязняющих веществ. Хроматомасс-спектрометрия, особенности использования для анализа загрязняющих веществ.
Масс-спектроскопия (МС) основана на получении ионов из нейтральных молекул путем воздействия на них пучком электронов, обладающих энергией достаточной для ионизации. При этом образуются «+» заряженные ионы, которые могут распадаться на отдельные фрагменты. Регистрируемая зависимость ионных токов от массы отдельных фрагментов называется масс-спектром.
Молекулы возбуждаются при взаимодействии с электронами, энергия которых больше 1000 кДж/моль. Молекула, возбужденная в результате взаимодействия с электроном, распадается с образованием положительного иона и электрона. Этот процесс называется ионизацией, образующийся положительный ион - молекулярным ионом.
М + е- → М*→ М+ + 2е- - процесс ионизации.
Молекулярный ион (М+) обладает значительной внутренней энергией и быстро (10-8 – 10-10с) распадается на отдельные заряженные и незаряженные фрагменты. Этот процесс называется фрагментацией. Фрагментация идет до тех пор, пока не образуются ионы, внутренняя энергия которых будет недостаточна для дальнейшего распада.
М
– фрагментация
 +
→ А+
+ В (В+ +А)
+
→ А+
+ В (В+ +А)
М+ → С+ + Д (Д++С)
Образующиеся молекулярные ионы и его заряженные фрагменты детектируются по их массовым числам, представляющим собой отношение их массы к заряду: m/е, при этом получается масс-спектр. Так как образуется однозарядные ионы, то отношение m/е составляет массу иона. Масс-спектр представляет собой спектр линий положительно заряженных ионов, где по оси абсцисс откладывают значения m/е, а по оси ординат - относительные интенсивности ионного тока.
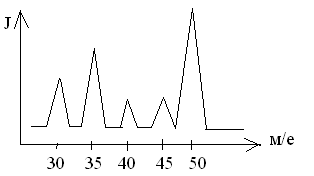
Рис 9. Масс-спектр
Анализ масс-спектра производится следующим образом: интенсивность самого большого пика принимается за 100% (основной пик), а интенсивности остальных пиков рассчитывается по отношению к основному пику и строится масс-спектр.
Подсчет начинают с отношения
m/е = 28 (N2+) или
m/e = 32 (О2+)
m/e = I8 (H2О+)
Используя МС можно установить структуру вещества, произвести качественный и количественный анализ, используя табличные данные, которые содержат разность масс, вероятный фрагмент, соответствующий разности и вероятный класс соединений, содержащий данный фрагмент (пример).
Разность масс |
Вероятный фрагмент |
Вероятный класс соединений |
1 |
Н |
Адегиды, фенолы, ароматические амины распадаются с фрагментом Н |
16 |
NH2 |
Амиды |
17 |
ОН |
Спирты, карбоновые кислоты |
18 |
Н2O |
Спирты, альдегиды |
Например, при фрагментации молекулярного иона н-бутана образуются следующие заряженные фрагменты:
СН3│– СН2 │– СН2 – СН3+ m/е =58
→ СН3+ m/е =15
→ СН2 - СН2 │– СН3+ m/е = 43
→ 2СН3- СН2+ m/е = 29
→ СН2 - СН2+ m/е = 28
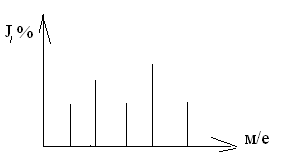
Рис 10. Масс-спектр н-бутана
Хроматомасс-спектрометрия (ХМС)- это сочетание газовой или жидкостной хроматографиии с масс-спектрометром, где масс-спектрометр является детектором. ХМС является более эффективным методом, чем каждый метод в отдельности. Сначала анализируемую смесь фракционируют на отдельные фракции с использованием ГХ или ЖХ, затем полученные фракции анализируют с помощью масс-спектрометра.
ХМС - универсальный метод, характеризуется высокой чувствительностью, селективностью, дает информацию о структуре веществ и их количественном содержании. ХМС используют для определения содержания в окружающей среде стойких органических загрязнителей: пестицидов, диоксинов, ПХБ и т д.
В современных масс-спектрометрах диапазон массовых чисел варьирует от 1 до 1000, а чувствительность составляет 10-9 – 10-12 (до 10-14) г/л (г/кг). Минимальное количество вещества для анализа ≈ 20 мкг.
