
- •Министерство образования и науки Российской Федерации
- •1. Спирты
- •1.1. Предельные одноатомные спирты
- •1.2. Непредельные одноатомные спирты
- •1.3. Двухатомные спирты, или гликоли
- •1.4. Трехатомные спирты, или глицерины
- •1.5. Фенолы
- •1.6. Многоатомные фенолы
- •2. Простые эфиры
- •3. Альдегиды и кетоны
- •3.2. Непредельные альдегиды и кетоны
- •4. Карбоновые кислоты
- •4.1. Предельные одноосновные кислоты
- •2. Синтез через магнийорганические соединения из галогенпроизводных соединений:
3.2. Непредельные альдегиды и кетоны
В молекуле ненасыщенных оксосоединений
присутствуют две реакционноспособные
группировки: карбонильная группа
![]() и двойная связь
и двойная связь
![]() . Группировки и их взаимное положение
определяют химическое поведение этих
соединений. Две ненасыщенные связи
и
могут находиться у одного углеродного
атома
. Группировки и их взаимное положение
определяют химическое поведение этих
соединений. Две ненасыщенные связи
и
могут находиться у одного углеродного
атома
![]() (кумулированные связи) и быть разделены
простой связью
(кумулированные связи) и быть разделены
простой связью
![]() (сопряженные связи) и, наконец, удалены
друг от друга. Соединения третьей группы
обладают всеми свойствами оксосоединений
и алкенов.
(сопряженные связи) и, наконец, удалены
друг от друга. Соединения третьей группы
обладают всеми свойствами оксосоединений
и алкенов.
Рассмотрим некоторые сопряженные, или α , β - ненасыщенные, альдегиды и кетоны.
Акролеин (акриловый альдегид, 2-пропеналь) CH2=CH–CHO - жидкость с удушливым запахом; т. пл. - 87,7 0С, т. кип. 52,7 0С, d420 = 0,839; растворяется в воде (20,85 % при 20 0С) и в органических растворителях.
Получают акролеин конденсацией формальдегида с уксусным альдегидом:

Метаналь Этаналь 2-Пропеналь
или каталитическим окислением пропилена:

Пропен 2-Пропеналь
Взаимное влияние двойной этиленовой связи и карбонильной группы находит отражение в ходе химической реакций:
а) присоединение HBr не соответствует правилу Марковникова:

3-Бромпропеналь
б) синильная кислота присоединяется по карбонильной группе:

в) гидросульфит натрия присоединяется как по карбонильной группе, так и по этиленовой связи:
![]()
Акролеин используется в синтезе глицерина, акриловой кислоты, метилметакрилата, пиридина, лекарственных препаратов.
Метилвинилкетон (2-бутенон)
является простейшим
![]() представителем непредельных
кетонов. Это жидкость, т. кип. 81, 4 0С,
d420 = 0,863; растворяется в
воде и органических растворителях.
представителем непредельных
кетонов. Это жидкость, т. кип. 81, 4 0С,
d420 = 0,863; растворяется в
воде и органических растворителях.
Метилвинилкетон получают гидратацией винилацетилена по реакции Кучерова:
![]()
а также конденсацией формальдегида с ацетоном с последующей дегидратацией образовавшегося кетоноспирта:

В отличие от акролеина метилвинилкетон присоединяет синильную кислоту не по карбонильной группе, а по этиленовой связи:
![]()
Метилвинилкетон легко полимеризуется в прозрачную бесцветную стекловидную массу.
Представителем непредельных оксосоединений с куммулированными связями является кетен.
Кетен. Кетенами называют
соединения, содержащие группировку
![]() . Кетен - токсичный газ, т.пл. -134,6 0С,
т. кип. -41 0С. В производственных
условиях его получают каталитическим
пиролизом уксусной кислоты или ацетона
при температуре 700-800 0С:
. Кетен - токсичный газ, т.пл. -134,6 0С,
т. кип. -41 0С. В производственных
условиях его получают каталитическим
пиролизом уксусной кислоты или ацетона
при температуре 700-800 0С:
![]()
Кетен не обнаруживает обычных кетонных свойств - не образует оксима и фенилгидразина, но обладает большой склонностью к реакциям присоединения. Чрезвычайно реакционноспособен. Применяют для получения уксусной кислоты, уксусного ангидрида и других продуктов:
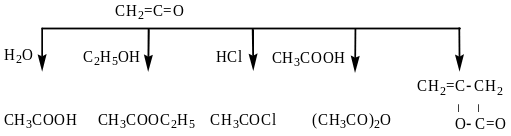
Уксусная Этилацетат Хлористый Уксусный Дикетен
кислота ацетил ангидрид
3.3. ДИАЛЬДЕГИДЫ И ДИКЕТОНЫ
Среди карбонильных соединений встречаются такие, которые содержат в молекуле две альдегидные или две кетонные группы. Они называются соответственно диальдегидами или дикетонами. По взаимному расположению этих групп в цепи различают α , β , γ и т.п. диальдегиды и дикетоны. Простейшие из них:
|
- Глиоксаль, этаналь, - диальдегид, диформил, щавелевый альдегид; |
|
- Малоновый альдегид, - диальдегид; |
|
- Янтарный альдегид, 1,4-бу-таналь, - диальдегид;
|
|
- Диацетил, 2,3-бутандион, - дикетон; |
|
- Ацетилацетон, 2,4-пентандион, - дикетон; |
|
- Ацетонилацетон, 2,5-гександион, - дикетон. |
Глиоксаль (этандиаль, α - диальдегид, диформил, или щавелевый
альдегид) - кристаллическое вещество желтого цвета; т.пл. 15,0 0С, т. кип. 50,4 0С, d420 = 1,14; растворяется в воде и органических растворителях, раздражает кожу.
Глиоксаль получают окислением этиленгликоля, спирта, уксусного альдегида диоксидом селена или кислородом воздуха на медном катализаторе при 250 0С:

Глиоксаль
В химических реакциях может участвовать как одна, так и две карбонильные группы, например:
![]()
Монооксим Диоксим
глиоксаля глиоксал

Фенилгидразон Озазон
При воздействии концентрированного раствора KOH глиоксаль превращается в оксиуксусную, или гликолевую кислоту (происходит внутримолекулярное окисление-восстановление, реакция Канницаро):

Глиоксаль легко полимеризуется. Его применяют для получения кубовых красителей, для пропитки кожи, бумаги.
Диацетил (диметилглиоксаль, 2,3-бутандион, α - дикетон) CH3 − CO − CO − CH3 - желто - зеленая жидкость, т.пл. -2,4 0С, т. кип. 88 0С,
d420 = 0,981, растворяется в воде (25 % при 15 0С), в органических растворителях.
Диацетил получают гидратацией винилацетилена с последующим окислением продукта:

а также окислением метилэтилкетона обработкой азотистой кислотой или амиловым эфиром:

Затем полученный нитрозокетон изомеризуется в монооксим дикетона:

При кипячении монооксима дикетона с разбавленной серной кислотой получают диацетил и гидроксиламин:

Диацетил Гидроксиламин
Диацетил вступает в реакции, свойственные кетонам. С гидроксиламином диацетил может образовать моно- или диоксим (диметил-глиоксим):

Диметилглиоксим
При взаимодействии диметилглиоксима с ионами никеля выпадает характерный кристаллический осадок малиново-красного цвета. Эта реакция открыта Л.А. Чугаевым (1906). Она используется в аналитической химии для качественного и количественного определения никеля. Осадок - внутрикомплексная соль хелатного (клешнеобразного) строения:

Диацетил содержится в сливочном масле, придавая ему характерный приятный запах. Вместе с другими веществами он обусловливает также запах кофе и меда, применяется в качестве ароматизирующего вещества для сыров, маргарина и кремов.
Ацетилацетон (2,4 - пентандион, β - дикетон)
![]()
- бесцветная жидкость; т. кип. 140,5 0С, d420 = 0,976; растворяется в воде (12,5 %), хлороформе, эфире, ацетоне, бензоле и в концентрированных карбоновых кислотах.
Ацетилацетон получают конденсацией (по Клайзену) элилацетата с ацетоном в присутствии алкоголята натрия:

Этилацетат Ацетон Ацетилацетон
Это прекрасный растворитель ацетатов целлюлозы. Реагент для концентрирования и экстракционного разделения металлов, экстракционно-фотометрического определения Fe (III), Co (III), U (VI), C (III), Mn (II).
Ацетилацетон легко гидролизуется под влиянием теплых щелочей с образованием ацетона и соли уксусной кислоты:

Ацетилацетон способен к таутомерному превращению, т.е. к самопроизвольной обратимой равновесной изомеризации - кетоенольной таутомерии:

Дикетонная форма (15 %) Кетоенольная форма (85 %)
При этом получается непредельный спирт, который может взаимодействовать со щелочными металлами, а также с железом, алюминием, медью, хромом и другими металлами, образуя еноляты, которые имеют строение внутрикомплексных солей хелатного типа

Соединения хелатного строения применяют для получения особо чистых металлов.
3.4. АРОМАТИЧЕСКИЕ АЛЬДЕГИДЫ
Ароматические альдегиды и кетоны содержат в своем составе карбонильную группу , связанную с атомом углерода бензольного ядра или боковой цепи.
Ароматические альдегиды - это производные ароматических углеводородов, в боковой цепи которых имеется альдегидная группа

Возможны два типа ароматических альдегидов:
а) альдегидная группа, непосредственно связанная с бензольным ядром, например

Бензойный альдегид,
бензальдегид
б) альдегидная группа непосредственно не связанная с бензольным ядром и находящаяся в боковой цепи

Фениуксусный альдегид
Соединения этого типа по химическим свойствам мало отличаются от альдегидов жирного ряда.
Способы получения. Окисление ароматических углеводородов кислородом воздуха на ванадиевом катализаторе:

Толуол Бензальдегид
Окисление ароматических спиртов:

Бензиловый спирт Бензальдегид
Гидролиз ароматических дигалогенопроизводных:

Хлористый бензилиден Бензальдегид
Восстановление хлорангидридов ароматических кислот на палладиевых или никелевых катализаторах:

Хлорангидрид Бензальдегид
бензойной кислоты
Физические свойства. Ароматические альдегиды - преимущественно жидкости с приятным запахом, трудно растворимые в воде.
Химические свойства. Ароматические альдегиды вступают во все химические реакции, характерные для альдегидов алифатического ряда.
В отличие от альдегидов жирного ряда ароматические альдегиды вступают в окислительно-восстановительное взаимодействие с образованием соответствующего спирта и соли кислоты (реакция Канницаро, 1853)

Калиевая соль Бензиловый
бензойной кислоты спирт
Реакция конденсации. За счет карбонильной группы ароматические альдегиды легко вступают в реакции конденсации с альдегидами, кетонами и сложными эфирами жирного ряда, в которых имеются подвижные атомы водорода в α - положении к карбонильной группе. Например:

Бензойный Уксусный Непредельный (коричный)
альдегид альдегид альдегид
Большое промышленное значение имеет реакция конденсации ароматических альдегидов с ароматическими фенолами и аминами. Так получают красители трифенилметанового ряда:

Бензойный Фенол Диокситрифенилметан
альдегид

Анилин Азометин
(Шиффовы основания)
Бензоиновая реакция. Под влиянием цианистого калия (катализатор) две молекулы ароматического альдегида взаимодействуют так, что водород альдегидной группы одной молекулы перемещается к карбонильному кислороду другой, и обе молекулы соединяются карбонильными углеродами с образованием ароматического оксикетона. Из бензойного альдегида при этом получается бензоин, отсюда такое взаимодействие называется бензоиновой реакцией:

Бензойный Бензойный Бензоин
альдегид альдегид
Реакции замещения в бензольном ядре. Альдегидная группа влияет на реакции замещения в бензольном ядре преимущественно как заместитель второго рода. Например, при нитровании бензойного альдегида главным продуктом реакции является м-нитробензальдегид:

Бензальдегид м-Нитробензальдегид
Бензойный альдегид (бензальдегид) - жидкость с т. пл. -26 0С, т. кип. 179,2 0С; d420 = 1,044-1,046. На воздухе быстро окисляется в бензойную кислоту. Содержится во многих эфирных маслах, в косточках вишни, персика, абрикоса. Имеет запах горького миндаля. Применяется в производстве душистых веществ и красителей.
3.5. АРОМАТИЧЕСКИЕ КЕТОНЫ
Ароматические кетоны - производные ароматических углеводородов, содержащие карбонильную группу , соединенную с двумя радикалами, из которых один обязательно ароматический. При этом различают две группы кетонов:
а) жирно-ароматические (смешанные), кетоны, в которых один из радикалов алкил, а второй - арил, например:

Ацетофенон метилфенилкетон
б) чисто ароматические кетоны, в которых оба радикала ароматические, например простейший из них:

Бензофенон, дифенилкетон
Способы получения. Реакция Фриделя-Крафтса заключается в воздействии на ароматический углеводороды хлорангидридов кислот в присутствии хлористого алюминия:

Бензол Хлористый ацетил Ацетофенон

Бензол Хлористый Бензофенон
бензоил
Конденсацией ароматических альдегидов с жирными кетонами получают непредельные ароматические кетоны:
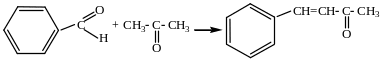
Бензальдегид Ацетон Метилфенилэтиленкетон
Другие способы аналогичны способам получения кетонов жирного ряда.
Физические свойства. Ароматические кетоны - жидкости или твердые вещества с приятным цветочным запахом. Нерастворимы в воде.
Химические свойства. Ароматические кетоны дают все реакции, характерные для кетонов жирного ряда: окисления, восстановления (не реагирует с NaHSO3), присоединения спиртов и синильной кислоты, галогенирования, замещения кислорода на галоген, конденсации, образования фенилгидразинов, оксимов и др. Чисто ароматические кетоны расщепляются амидом натрия:

Эта реакция позволяет устанавливать строение ароматических кетонов.
3.6. ХИНОНЫ
С ароматическими соединениями ряда бензола тесно связаны хиноны - своеобразные соединения с шестичленной, как в бензоле, циклической группировкой, содержащей две кетонные группы и две двойные связи. Строение их выражают следующие структурные формулы или принятые условные символы:

или или
1,4-Бензохинон 1,2-Бензохинон
(п-Бензохинон) (о-Бензохинон)
Формулу хинона с 1,3 (или мета-) расположением кетонных групп в шестичленном цикле с двумя двойными связями написать невозможно- м-хиноны не существуют.
Простейшим и наиболее важным представителем этого класса является 1,4-бензохинон, или просто хинон. На его примере мы и рассмотрим особенности строения и свойства хинонов.
В кольце хинона нет характерной для бензольного ядра системы связей. Две двойные связи в нем по своей природе близки к обычным этиленовым связям, причем каждая из них образует сопряженные системы с двойными связями обеих карбонильных групп. Кольцо хинона по химическому характеру отличается от ядра бензола, и поэтому хинон проявляет ряд специфических свойств.
В то же время хинон тесно связан с ароматическими соединениями рядом превращения. Так, например, он получается при окислении п-диоксибензола (гидрохинона). В свою очередь, хинон является сильным окислителем и легко восстанавливается в гидрохинон. Взаимопревращения хинона и гидрохинона можно представить следующим окислительно-восстановительным равновесием:

Хинон Гидрохинон
Характерная для хинона так называемая хиноидная (п-хиноидная) группировка атомов и связей

или
встечается или может образовываться во многих сложных органических соединениях, например, в красящих веществах.
Известны хиноны, родственные многоядерным конденсированным ароматическим углеводородам. Например, хиноны, имеющие циклические системы нафталина и антрацена:

1,4-Нафтохинон 9,10-Антрахинон
( α -Нафтохинон)
Вопросы и упражнения
1. Заполните схему превращений:
![]()
2. Осуществите превращения:
а) CH3–CH=CH–CHO → CH3–CH=CH–COOH
б) CH2=CH–CHO → CH2(OH)–CH(OH)CH2OH
в) CH2=C=O → CH3–CO–OCH2CH2CH3
г) CH2=CH–CO–CH3 → CH2=CH–COOH
3. Напишите уравнения реакций. Назовите исходные и конечные органические соединения:
CH3–CH=CH–CHO + HBr → (CH3)2C=C=O + CH3CH2OH
4. Предложите схемы получения из бензальдегида следующих соединений:
а) п-бромбензилового спирта, б) м-нитробензойной кислоты, в) α -фенилэти-лового спирта, г) дифенилкарбинола, д) N -бензиланилина, е) миндальной кислоты C6H5CH(OH)COOH.
5. Как из ацетофенона и любых других реагентов можно получить: а) этилбензол, б) бензойную кислоту, в) α - фенилэтиловый спирт, г) 2-фенил - 2 - бутанол, д) ди - фенилметилкарбинол, е) α -окси- α -фенилпропионовую кислоту? Приведите схемы реакций.
6. Осуществите следующие превращения:
C6H5CHO → C6H5CH2CH2NH2
(C6H5)2CO → C6H5–CO–NH–C6H5
7. Назовите соединение, являющееся продуктом следующих реакций:
![]()
8. Приведите схемы получения бензальдегида: а) из бензола, б) толуола, в) бензилового спирта, г) бензойной кислоты, д) бензилиденхлорида.
9. Напишите схемы синтеза ацетофенона: а) окислением соответствующего углеводорода, б) окислением спирта, в) гидролизом дигалогенпроизводного, г) ацилированием по Фриделю-Крафтсу, д) реакцией Гриньяра.
10. Назовите соединения:
а) б)

в) г) д)

11. Назовите хиноны, которые являются продуктами следующих реакций:
а) б) в)

