
- •Глава хii. Гетероциклические соединения
- •XII.1. Пятичленные гетероароматические соединения с одним гетероатомом
- •XII.1.1. Одноядерные (моноциклические) соединения
- •XII.1.1.1. Способы получения
- •I. Методы замыкания гетероциклов.
- •II. Взаимные превращения гетероциклов.
- •XII.1.1.2. Свойства
- •I. Кислотно-основные свойства
- •II. Реакции электрофильного замещения в ядре.
- •III. Реакции присоединения.
- •Конденсированные производные пиррола, фурана, тиофена.
- •XII.1.2. Индол
- •XII.1.2.1. Способы получения
- •XII.1.2.2. Свойства
- •I. Кислотно-основные свойства
- •II. Реакции электрофильного замещения
- •III. Окисление и восстановление
- •XII.1.3. Пятичленные гетероароматические соединения с двумя гетероатомами
- •Диазолы
- •XII.1.3.1. Пиразол и его производные
- •XII.1.3.2. Имидазол и его производные
- •XII.1.4. Природные соединения, содержащие пятичленные гетероциклы
- •XII.2. Шестичленные гетероароматические соединения с одним гетероатомом
- •XII.2.1. Пиридин и его производные
- •XII.2.1.1. Получение
- •I. Методы замыкания пиридинового цикла
- •II. Получение из других гетероциклических систем
- •XII.2.1.2. Свойства
- •I. Производные пиридина как третичные амины.
- •II. Электрофильное замещение в пиридиновом ядре.
- •IV. Реакции положения к пиридиновому ядру.
- •V . Реакции окисления и восстановления
- •VI. Таутомерия гидрокси- и аминопиридинов.
II. Реакции электрофильного замещения в ядре.
Как уже указывалось выше, для избыточных гетероциклов прогнозируется повышенная реакционная способность в реакциях электрофильного замещения. Действительно, пиррол и фуран чрезвычайно реакционноспособны в этих реакциях, причем пиррол в большей степени, чем фуран; тиофен менее активен, чем пиррол и фуран, но более активен, чем бензол.
Реакции электрофильного замещения в данных гетероциклах идут по обычным механизмам ароматического замещения – с промежуточным образованием катионных аддуктов. Реакции, как правило, региоселективны: они предпочтительно идут по положению 2. Такую регионаправленность легко объяснить, если рассмотреть структуры альтернативных -аддуктов при замещении в положениях 2 и 3:
П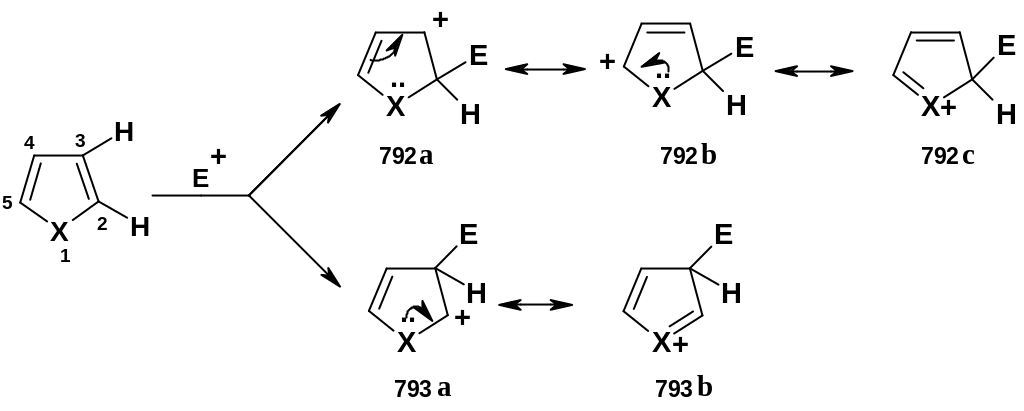 ри
замещении в положении 2 -аддукт
может быть представлен тремя
резонансными
структурами (792а-с), в то время, как при
замещении в положении 3 – только двумя
(793а,b);
следовательно, первый -аддукт
более устойчив. Если положение 2 занято,
замещение идет в положении 3. В некоторых
случаях реакции идут более, чем по одному
положению, вплоть до полного замещения
всех атомов водорода.
ри
замещении в положении 2 -аддукт
может быть представлен тремя
резонансными
структурами (792а-с), в то время, как при
замещении в положении 3 – только двумя
(793а,b);
следовательно, первый -аддукт
более устойчив. Если положение 2 занято,
замещение идет в положении 3. В некоторых
случаях реакции идут более, чем по одному
положению, вплоть до полного замещения
всех атомов водорода.
Реакции электрофильного замещения для пиррола, фурана и тиофена, в принципе, те же, что и для бензоидных соединений, но условия их проведения достаточно специфичны. В частности, на пиррол и фуран нельзя действовать сильными кислотами, т.к. данные гетероциклы при этом разлагаются (они ацидофобны, см. выше); поэтому для нитрования и сульфирования этих соединений не используют азотную и серную кислоты. Тиофен устойчив в водных растворах сильных кислот, но неустойчив в 100%-й H2SO4.
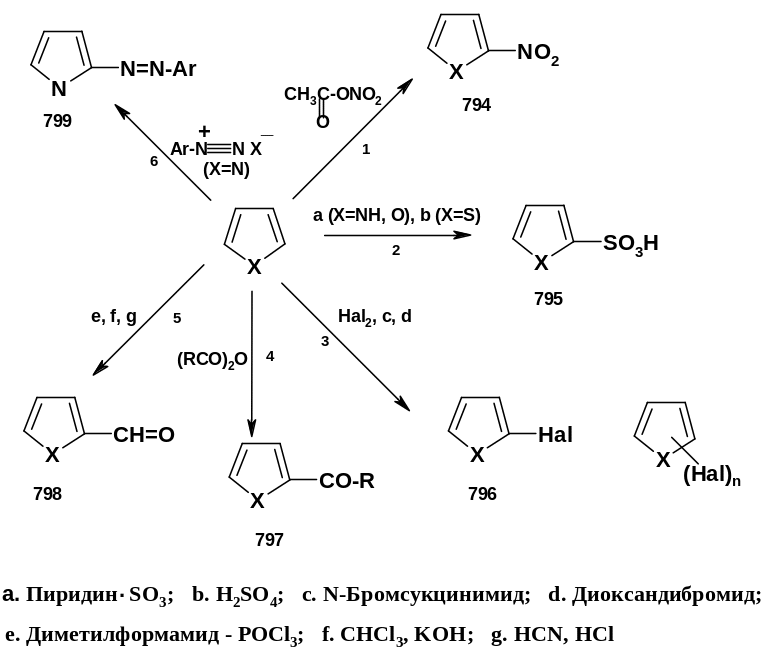 1.
Нитрование
фурана и пиррола проводят действием
ацетилнитрата
СН3СО-ONO2
- смешанного ангидрида уксусной и азотной
кислот; этот мягкий нитрующий реагент
получают из азотной кислоты и уксусного
ангидрида; он нитрует в нейтральной
среде. Для нитрования тиофена обычно
также используют ацетилнитрат. Продукты
реакции – 2-нит- ропроизводные (794).
1.
Нитрование
фурана и пиррола проводят действием
ацетилнитрата
СН3СО-ONO2
- смешанного ангидрида уксусной и азотной
кислот; этот мягкий нитрующий реагент
получают из азотной кислоты и уксусного
ангидрида; он нитрует в нейтральной
среде. Для нитрования тиофена обычно
также используют ацетилнитрат. Продукты
реакции – 2-нит- ропроизводные (794).
2. Сульфирование фурана и пиррола проводят, используя в качестве реагента комплекс пиридина с триоксидом серы; для сульфирования тиофена используют серную кислоту; поскольку тиофен сульфируется легче бензола, эта реакция используется для отделения примеси тиофена от «каменноугольного» бензола. Продукты сульфирования – 2-сульфо- производные (795).
3. Галогенирование пиррола, фурана и тиофена галогенами обычно приводит к продуктам полизамещения. Пиррол при действии брома в этаноле образует продукт полного бромирования – 2,3,4,5-тетрабромпиррол, при взаимодействии с системой J2/KJ – тетраиодпиррол. Даже тиофен при действии хлора образует смесь продуктов полизамещения. При действии более мягких галогенирующих реагентов галогенирование идет селективно: при действии на пиррол N-бромсукцинимида (стр. 93) образуется 2-бромпиррол (696, Х=NH, Hal=Br); при действии на фуран комплекса брома с диоксаном (диоксандибромида) образуется 2-бромфуран (796, X=O, Hal=Br).
4. Ацилирование проходит чаще всего при действии ангидридов карбоновых кислот; для фурана используют в качестве катализатора SnCl4 или BF3, для тиофена – AlCl3. Образуются кетоны – 2-ацилпроизводные (797).
5. Формилирование – специфический частный случай ацилирования – можно (как и для фенолов) проводить по Вильсмайеру, т.е. системой диметилформамид – РОС13 (стр. 243), по Раймеру-Тиману – системой СНС13 – КОН (стр. 243) – для пиррола, а также системой НСN – HCl (для пиррола и фурана). Продукты формилирования – альдегиды (2-формилпроизводные) (798). Особенно важное значение имеет формилирование производных пиррола, поскольку пиррол-2-альдегиды используются в синтезах важных природных систем – порфиринов, входящих, в частности, в состав хлорофилла и гемоглобина.
6. Азосочетание происходит при взаимодействии пиррола (но не фурана и тиофена) с солями арилдиазония; образуются азосоединения (799), содержащие пиррольный фрагмент. Эти реакция, как и формилирование, подчеркивает сходство пиррола с фенолами и ароматическими аминами.
Еще одна важная электрофильная реакция, специфичная для пиррола – конденсация с карбонильными соединениями; здесь также наблюдается аналогия с фенолами (см. конденсацию фенола с формальдегидом, стр. 200). Реакция идет отчасти аналогично фенол-альдегидной конденсации и может привести к образованию полимерных продуктов; однако в некоторых случаях могут быть выделены циклические тетрамеры:
В частности, при взаимодействии пиррола
с бензальдегидом в кислой среде образуется
циклический тетрамер (800), который под
действием кислорода воздуха окисляется
в тетрафенилпорфирин (801).
частности, при взаимодействии пиррола
с бензальдегидом в кислой среде образуется
циклический тетрамер (800), который под
действием кислорода воздуха окисляется
в тетрафенилпорфирин (801).
