
- •Глава хii. Гетероциклические соединения
- •XII.1. Пятичленные гетероароматические соединения с одним гетероатомом
- •XII.1.1. Одноядерные (моноциклические) соединения
- •XII.1.1.1. Способы получения
- •I. Методы замыкания гетероциклов.
- •II. Взаимные превращения гетероциклов.
- •XII.1.1.2. Свойства
- •I. Кислотно-основные свойства
- •II. Реакции электрофильного замещения в ядре.
- •III. Реакции присоединения.
- •Конденсированные производные пиррола, фурана, тиофена.
- •XII.1.2. Индол
- •XII.1.2.1. Способы получения
- •XII.1.2.2. Свойства
- •I. Кислотно-основные свойства
- •II. Реакции электрофильного замещения
- •III. Окисление и восстановление
- •XII.1.3. Пятичленные гетероароматические соединения с двумя гетероатомами
- •Диазолы
- •XII.1.3.1. Пиразол и его производные
- •XII.1.3.2. Имидазол и его производные
- •XII.1.4. Природные соединения, содержащие пятичленные гетероциклы
- •XII.2. Шестичленные гетероароматические соединения с одним гетероатомом
- •XII.2.1. Пиридин и его производные
- •XII.2.1.1. Получение
- •I. Методы замыкания пиридинового цикла
- •II. Получение из других гетероциклических систем
- •XII.2.1.2. Свойства
- •I. Производные пиридина как третичные амины.
- •II. Электрофильное замещение в пиридиновом ядре.
- •IV. Реакции положения к пиридиновому ядру.
- •V . Реакции окисления и восстановления
- •VI. Таутомерия гидрокси- и аминопиридинов.
II. Взаимные превращения гетероциклов.
 Фуран,
пиррол и тиофен превращаются друг в
друга при нагревании до 400-500
оС в
присутствии оксидных катализаторов и
соответствующих нуклеофилов – аммиака,
сероводорода, воды:
Фуран,
пиррол и тиофен превращаются друг в
друга при нагревании до 400-500
оС в
присутствии оксидных катализаторов и
соответствующих нуклеофилов – аммиака,
сероводорода, воды:
Реакции были открыты Ю.К. Юрьевым. Лучше всего проходят превращения фурана в пиррол и тиофен, выходы продуктов остальных реакций невелики. Производные фурана переходят в соответствующие производные тиофена под действием сероводорода в присутствии минеральных кислот даже при невысоких температурах (В.Г. Харченко, Т.И. Губина).
XII.1.1.2. Свойства
Электронная структура пятичленных ароматических гетероциклов с одним гетероатомом может быть представлена в виде гибрида резонансных структур (791а-е):
[ Частный
случай – структура пиррола – рассматривался
ранее (стр. 33)].
Частный
случай – структура пиррола – рассматривался
ранее (стр. 33)].
Исходя из электронной структуры гетероциклов, можно сделать следующие выводы:
А. Электронная плотность на атомах углерода данных гетероциклов выше, чем на атомах углерода в бензоле; поэтому эти гетероциклы называют избыточными. Сходная ситуация наблюдается для производных бензола, содержащих электронодонорные заместители, прежде всего для фенолов и ароматических аминов. Подобно фенолам и аминам, пиррол, фуран и тиофен должны очень легко реагировать с электрофильными реагентами.
Б. Энергия стабилизации для данных гетероциклов меньше, чем для бензола: для них возможна только одна незаряженная резонансная структура (791а), в то время как для бензола – две эквивалентных структуры Кекуле.
В. Поскольку гетероатомы более электроотрицательны, чем атомы углерода, степень делокализации электронной плотности в гетероциклах меньше, чем в бензоле: неподеленная пара электронов гетероатома не полностью участвует в делокализации, оставаясь частично «привязанной» к гетероатому. Этот эффект наибольший для фурана (атом кислорода наиболее электроотрицателен) и наименьший для тиофена. Поэтому фуран в наименьшей степени проявляет ароматический характер, а тиофен – в наибольшей; он относительно близок по свойствам к бензолу. Пиррол занимает промежуточное положение, находясь, пожалуй, всё же ближе к фурану, чем к тиофену.
Г. Поскольку неподеленная пара гетероатома участвует в «ароматической» делокализации, основность гетероатома должна быть меньше, чем в неароматических аналогах, например спиртах и аминах.
I. Кислотно-основные свойства
Кислотно-основные свойства, прежде всего основность (отношение к кислотам) заметно сказывается на условиях проведения других реакций (прежде всего электрофильного замещения), поэтому целесообразно рассмотреть эти свойства в первую очередь.
А. Основность. Делокализация неподеленной пары электронов гетероатома приводит к уменьшению основности гетероатома; в частности, пиррол – гораздо более слабое основание, чем алифатические амины. Тем не менее, пиррол и фуран при взаимодействии с кислотами протонируются, причем не по гетероатому, а по атому углерода, преимущественно в положении 2:
П ротонирование
в положение 2 предпочтительно, потому
что в образующемся катионе заряд наиболее
делокализован (легко убедиться, что при
протонировании по гетероатому заряд
не делокализован).
Протонированные
гетероциклы теряют ароматичность
и становятся заряженными
диеновыми структурами.
Поэтому они немедленно претерпевают
дальнейшие превращения: пиррол
полимеризуется (осмоляется), фуран
подвергается реакциям раскрытия цикла
(в частности, разбавленные минеральные
кислоты превращают производные фурана
в 1,4-дикарбонильные соединения – реакция,
обратная синтезу фуранового цикла).
Следовательно, действие кислот на пиррол
и фуран (и многие их производные) приводит
к их разрушению; эти соединения ацидофобны,
что необходимо учитывать при работе с
ними (избегать присутствия сильных
кислот). Производные пиррола и особенно
фурана, содержащие электроноакцепторные
заместители (СО-R,
COOH,
NO2)
протонируются труднее, поэтому они
более устойчивы в кислых средах. Также
и тиофен протонируется заметно хуже
пиррола и фурана, и его ацидофобность
гораздо меньше.
ротонирование
в положение 2 предпочтительно, потому
что в образующемся катионе заряд наиболее
делокализован (легко убедиться, что при
протонировании по гетероатому заряд
не делокализован).
Протонированные
гетероциклы теряют ароматичность
и становятся заряженными
диеновыми структурами.
Поэтому они немедленно претерпевают
дальнейшие превращения: пиррол
полимеризуется (осмоляется), фуран
подвергается реакциям раскрытия цикла
(в частности, разбавленные минеральные
кислоты превращают производные фурана
в 1,4-дикарбонильные соединения – реакция,
обратная синтезу фуранового цикла).
Следовательно, действие кислот на пиррол
и фуран (и многие их производные) приводит
к их разрушению; эти соединения ацидофобны,
что необходимо учитывать при работе с
ними (избегать присутствия сильных
кислот). Производные пиррола и особенно
фурана, содержащие электроноакцепторные
заместители (СО-R,
COOH,
NO2)
протонируются труднее, поэтому они
более устойчивы в кислых средах. Также
и тиофен протонируется заметно хуже
пиррола и фурана, и его ацидофобность
гораздо меньше.
 Б. Кислотность.
Пиррол обладает свойствами слабой
кислоты; по силе он сравним со спиртами.
Атом водорода при азоте можно заместить
на металл действием таких сильных
оснований, как амиды металлов или
металлорганические соединения:
Б. Кислотность.
Пиррол обладает свойствами слабой
кислоты; по силе он сравним со спиртами.
Атом водорода при азоте можно заместить
на металл действием таких сильных
оснований, как амиды металлов или
металлорганические соединения:
В частности, при действии амида калия образуется соль (805) – пиррол-калий; при действии реактивов Гриньяра – N-магниевое производное (806). В калиевом производном связь ионная, в магниевом – сильно полярная ковалентная.
В анионе пиррола (пирролил-анионе) отрицательный заряд делокализован, поэтому пирролил-анион – амбидентный нуклеофил. Металлические производные пиррола могут алкилироваться и ацилироваться, причем калиевое производное – преимущественно по жесткому центру - атому азота, а магниевое (и литиевое) – преимущественно по мягкому центру - атому углерода (в основном по положению 2):
Э ти
реакции – важный путь синтеза производных
пиррола.
ти
реакции – важный путь синтеза производных
пиррола.
Фуран и тиофен – более слабые кислоты, чем пиррол (они, естественно, являются СН-кислотами); тем не менее, при действии супероснований, таких, как н-бутиллитий, происходит замещение атома водорода в положении 2 на металл (при действии бутиллития – литиирование):
Л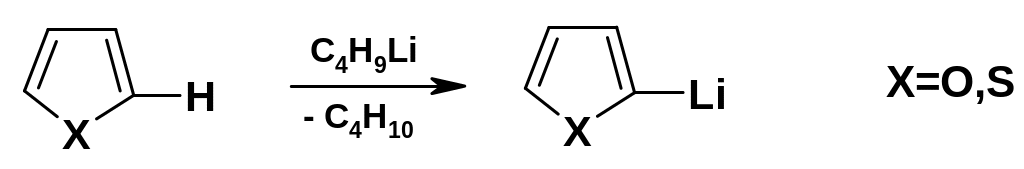 итиевые
производные широко используются для
синтезов различных производных фурана
и тиофена (по схемам обычных реакций
металлорганических соединений).
итиевые
производные широко используются для
синтезов различных производных фурана
и тиофена (по схемам обычных реакций
металлорганических соединений).
