
- •Глава хii. Гетероциклические соединения
- •XII.1. Пятичленные гетероароматические соединения с одним гетероатомом
- •XII.1.1. Одноядерные (моноциклические) соединения
- •XII.1.1.1. Способы получения
- •I. Методы замыкания гетероциклов.
- •II. Взаимные превращения гетероциклов.
- •XII.1.1.2. Свойства
- •I. Кислотно-основные свойства
- •II. Реакции электрофильного замещения в ядре.
- •III. Реакции присоединения.
- •Конденсированные производные пиррола, фурана, тиофена.
- •XII.1.2. Индол
- •XII.1.2.1. Способы получения
- •XII.1.2.2. Свойства
- •I. Кислотно-основные свойства
- •II. Реакции электрофильного замещения
- •III. Окисление и восстановление
- •XII.1.3. Пятичленные гетероароматические соединения с двумя гетероатомами
- •Диазолы
- •XII.1.3.1. Пиразол и его производные
- •XII.1.3.2. Имидазол и его производные
- •XII.1.4. Природные соединения, содержащие пятичленные гетероциклы
- •XII.2. Шестичленные гетероароматические соединения с одним гетероатомом
- •XII.2.1. Пиридин и его производные
- •XII.2.1.1. Получение
- •I. Методы замыкания пиридинового цикла
- •II. Получение из других гетероциклических систем
- •XII.2.1.2. Свойства
- •I. Производные пиридина как третичные амины.
- •II. Электрофильное замещение в пиридиновом ядре.
- •IV. Реакции положения к пиридиновому ядру.
- •V . Реакции окисления и восстановления
- •VI. Таутомерия гидрокси- и аминопиридинов.
II. Электрофильное замещение в пиридиновом ядре.
А. Пиридин и его N-незамещенные производные.
 Электрофильное
замещение в ядре пиридина протекает с
трудом – примерно на 6 порядков труднее,
чем в бензоле; это – следствие
дефицитности
пиридинового цикла. Реакции проходят
только в очень жестких условиях;
заместитель ориентируется в положение
3:
Электрофильное
замещение в ядре пиридина протекает с
трудом – примерно на 6 порядков труднее,
чем в бензоле; это – следствие
дефицитности
пиридинового цикла. Реакции проходят
только в очень жестких условиях;
заместитель ориентируется в положение
3:
Удается осуществить нитрование, сульфирование и галогенирование; алкилирование и ацилирование по Фриделю-Крафтсу не идут.
Как реакционную способность, так и регионаправленность замещения можно объяснить, если рассмотреть структуры аддуктов при замещении в положениях 2 и 3:
Э лектроноакцепторный
атом азота уменьшает стабильность
катионных аддуктов
(852) и (853), что снижает скорость замещения
(в действительности обычно в реакцию
вступает не пиридин, а катион пиридиния,
образующийся при протонировании
кислотой; в этом катионе атом азота
много более акцепторный, чем в пиридине;
это еще более затрудняет замещение).
При замещении в положении 2 образуется
максимально нестабильная форма (852а), в
которой положительный заряд локализован
на электроноакцепторном атоме азота;
при замещении в положении 3 такой формы
не возникает, и -аддукт
относительно более устойчив, точнее
менее неустойчив. Таким образом,
происходит выбор «лучшего из худшего»,
как при замещении в бензольном ядре,
содержащем ориентант II
рода, например, в нитробензоле.
лектроноакцепторный
атом азота уменьшает стабильность
катионных аддуктов
(852) и (853), что снижает скорость замещения
(в действительности обычно в реакцию
вступает не пиридин, а катион пиридиния,
образующийся при протонировании
кислотой; в этом катионе атом азота
много более акцепторный, чем в пиридине;
это еще более затрудняет замещение).
При замещении в положении 2 образуется
максимально нестабильная форма (852а), в
которой положительный заряд локализован
на электроноакцепторном атоме азота;
при замещении в положении 3 такой формы
не возникает, и -аддукт
относительно более устойчив, точнее
менее неустойчив. Таким образом,
происходит выбор «лучшего из худшего»,
как при замещении в бензольном ядре,
содержащем ориентант II
рода, например, в нитробензоле.
Производные пиридина, содержащие электронодонорные группы, реагируют легче. Уже 2,6-диметилпиридин (2,6-лутидин) нитруется при 100 оС с высоким выходом (в то время как пиридин при 300 оС – с выходом 5%): пиридиновый аналог фенола – 2-гидроксипиридин - может образовать даже динитропроизводное, хотя, конечно, менее активен, чем фенол:

 Б. N-оксиды
пиридина и его производных.
Эти соединения заметно активнее
N-незамещеных
пиридинов в реакциях нитрования; при
этом нитрогруппа становится в положение
4:
Б. N-оксиды
пиридина и его производных.
Эти соединения заметно активнее
N-незамещеных
пиридинов в реакциях нитрования; при
этом нитрогруппа становится в положение
4:
Полученный 4-нитро-N-оксид может быть дезоксигенирован действием РС13; таким образом, открывается возможность синтеза 4-нитропиридинов (а исходя из них – и других 4-замещенных пиридинов). Ориентация в положение 4 вытекает из структуры -аддукта:
Н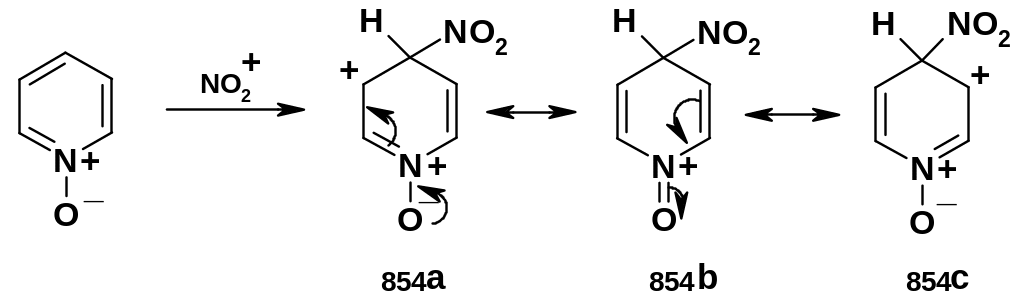 абор
резонансных структур включает весьма
стабильную структуру (854b),
имеющую только один заряд, причем на
аммонийном атоме азота. При замещении
в положении 3 такой устойчивой формы не
образуется.
абор
резонансных структур включает весьма
стабильную структуру (854b),
имеющую только один заряд, причем на
аммонийном атоме азота. При замещении
в положении 3 такой устойчивой формы не
образуется.
III.Взаимодействие производных пиридина с нуклеофильными реагентами.
Пиридин, как дефицитная структура, обладает бòльшим сродством к нуклеофильным реагентам, чем бензол. При действии нуклеофильных реагентов на пиридин и его N-незамещенные производные происходят, в основном, реакции замещения. При действии нуклеофилов на соли пиридиния могут происходить как реакции замещения, так и реакции присоединения.
А. Нуклеофильное замещение водорода. В достаточно жестких условиях атом водорода в положении 2 можно заместить на группы NH2 и ОН:

Реакцию с амидом натрия называют реакцией Чичибабина; она позволяет получать 2-аминопиридины с хорошим выходом и имеет заметное практическое значение как успешная реакция прямого аминирования ароматического ядра. Реакция гидроксилирования ядра при действии расплавленного КОН дает низкие выходы продуктов; однако для конденсированных систем с пиридиновым ядром результаты этой реакции лучше.
Реакции протекают по схеме присоединения-отщепления; в частности, наиболее вероятный механизм реакции Чичибабина следующий:
В ысоконуклеофильный
амид-анион присоединяется в положение
2 с образованием анионного аддукта
(855), где наиболее устойчивая резонансная
структура – (855а) (противоион Na+
на этой стадии опущен). Далее от аддукта
отщепляется гидрид-ион в виде гидрида
натрия (аддукт
представлен формой (855а), т.к. резонансный
гибрид близок к ней по структуре). В
условиях реакции (в безводной среде)
гидрид натрия реагирует с 2-аминопиридином
с выделением водорода и образованием
пиридиламида натрия (856) (здесь аминопиридин
проявляет свойства слабой кислоты); при
добавлении воды происходит его гидролиз
и регенерация 2-аминопиридина.
ысоконуклеофильный
амид-анион присоединяется в положение
2 с образованием анионного аддукта
(855), где наиболее устойчивая резонансная
структура – (855а) (противоион Na+
на этой стадии опущен). Далее от аддукта
отщепляется гидрид-ион в виде гидрида
натрия (аддукт
представлен формой (855а), т.к. резонансный
гибрид близок к ней по структуре). В
условиях реакции (в безводной среде)
гидрид натрия реагирует с 2-аминопиридином
с выделением водорода и образованием
пиридиламида натрия (856) (здесь аминопиридин
проявляет свойства слабой кислоты); при
добавлении воды происходит его гидролиз
и регенерация 2-аминопиридина.
Регионаправленность процесса очевидна: при замещении в положении 3 устойчивость аддукта меньше, т.к. здесь не образуется резонансной структуры с отрицательным зарядом на атоме азота.
 Еще один вариант
нуклеофильного замещения водорода в
пиридиновом ядре – реакции с
металлорганическими соединениями;
лучше всего они протекают с литийорганическими
соединениями:
Еще один вариант
нуклеофильного замещения водорода в
пиридиновом ядре – реакции с
металлорганическими соединениями;
лучше всего они протекают с литийорганическими
соединениями:
В результате происходит алкилирование или арилирование в положение 2. Механизм подобен механизму реакции Чичибабина; интересно то, что в некоторых случаях удается выделить промежуточные аддукты – N-литий-1,2-дигидропиридины (857); их можно использовать в различных синтезах.
Б. Нуклеофильное замещение галогена. Атомы галогена в 2- и 4-галогензамещенных пиридинах достаточно легко замещаются при взаимодействии с нуклеофильными реагентами:
С итуация
напоминает галогеннитробензолы. В
большинстве случаев реакции идут по
типу присоединения-отщепления с
образованием анионных -аддуктов
типа комплексов Мейзенгеймера.
итуация
напоминает галогеннитробензолы. В
большинстве случаев реакции идут по
типу присоединения-отщепления с
образованием анионных -аддуктов
типа комплексов Мейзенгеймера.
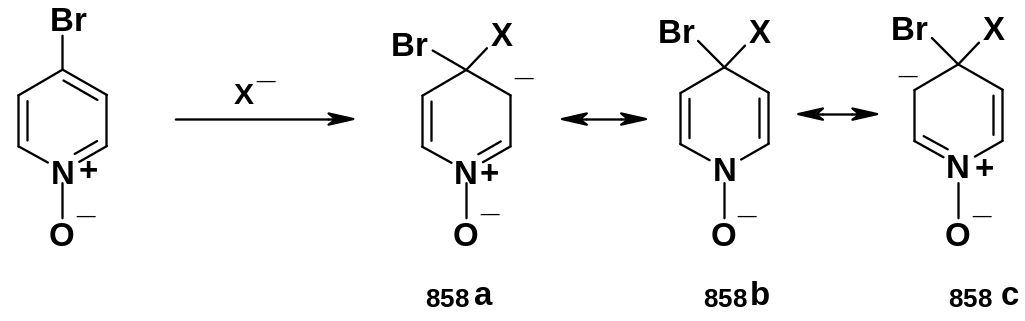 Для N-оксидов
галогенпиридинов замещение галогена
идет еще легче:
Для N-оксидов
галогенпиридинов замещение галогена
идет еще легче:
В анионном аддукте здесь присутствует устойчивая структура (858b), что и делает его более стабильным. Таким образом, N-оксидная группа активирует пиридиновое ядро по отношению и к электрофильным и к нуклеофильным реагентам. 2- и 4-Галогензамещенные пиридиниевые соли также очень легко замещают атомы галогена.
3-Галогенпроизводные пиридина реагируют с нуклеофилами труднее, чем 2- и 4-галогенпроизводные. Если в качестве нуклеофила использовать очень сильное основание (амид калия), то замещение идет по схеме отщепления-присоединения – по аринному механизму с промежуточным образованием дегидропиридина (859); разумеется, при этом наряду с «правильным» замещением [соединение 860)] идет кине-замещение [соединение (861)]:
П ромежуточно
образующийся дегидропиридин (859) можно
«поймать» химической ловушкой - диеном
(см. стр. 172); при использовании в качестве
такой ловушки фурана (стр. 507) можно
выделить аддукт диенового синтеза
(862).
ромежуточно
образующийся дегидропиридин (859) можно
«поймать» химической ловушкой - диеном
(см. стр. 172); при использовании в качестве
такой ловушки фурана (стр. 507) можно
выделить аддукт диенового синтеза
(862).
В. Нуклеофильное присоединение к солям пиридиния. Для солей пиридиния характерно присоединение достаточно сильных нуклеофилов в положение 2 или 4 с образованием производных 1,2- или 1,4-дигидропиридина:
Т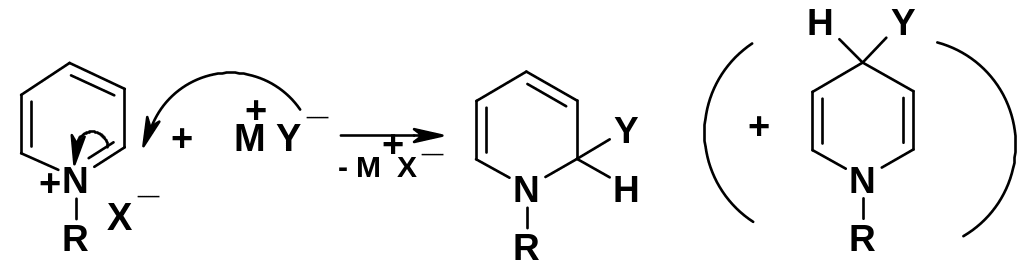 ак
присоединяется цианид-анион (М=K, Y=CN)-
преимущественно в положение 4,
алкоксид-анион (М=Na,
Y=OR)
– в положение 2, реактивы Гриньяра
(М=MgX,
Y=R)
– преимущественно в положение 2.
ак
присоединяется цианид-анион (М=K, Y=CN)-
преимущественно в положение 4,
алкоксид-анион (М=Na,
Y=OR)
– в положение 2, реактивы Гриньяра
(М=MgX,
Y=R)
– преимущественно в положение 2.
В некоторых случаях вслед за присоединением нуклеофила следует раскрытие пиридиниевого цикла, например, при реакции солей N-арилпиридиния с аминами:
В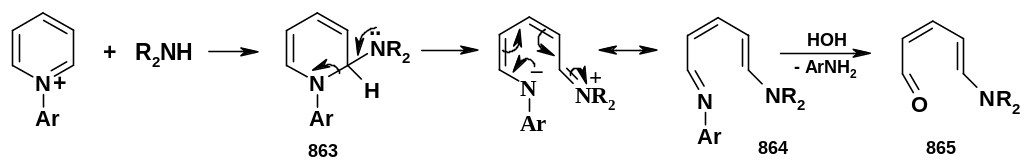 продукте присоединения (863) происходит
внутримолекулярное нуклеофильное
замещение с раскрытием цикла; образующийся
арилимин (864) гидролизуется водой;
конечным продуктом является
5-аминопентадиеналь (865).
продукте присоединения (863) происходит
внутримолекулярное нуклеофильное
замещение с раскрытием цикла; образующийся
арилимин (864) гидролизуется водой;
конечным продуктом является
5-аминопентадиеналь (865).
