
- •IX.2. Производные карбоновых кислот
- •IX.2.1. Производные формулы r-co-X
- •IX.2.1.1. Галогенангидриды карбоновых кислот (ацилгалогениды).
- •IX.2.1.2. Ангидриды карбоновых кислот.
- •IX.2.1.3. Сложные эфиры
- •Химические свойства
- •I. Нуклеофильные реакции карбонильной группы.
- •II. Реакции расщепления связи о-алкил.
- •III. Восстановление сложных эфиров.
- •Ацилоиновая конденсация
- •IV. Реакции пиролитического отщепления.
- •IX.2.1.4. Амиды и родственные соединения
- •Гидразиды
- •Гидроксамовые кислоты
- •IX.2.2.1. Имидоэфиры
- •IX.2.2.2. Амидины
- •IX.2.3. Ортоэфиры и ацетали амидов
- •IX.2.3.1. Ортоэфиры
- •IX.2.3.2. Ацетали амидов
- •IX.2.4. Кетены и нитрилы.
- •IX.2.4.1. Кетены
- •1. Взаимодействие с нуклеофильными реагентами.
- •IX.2.4.2. Нитрилы
- •IX.2.5. Производные угольной кислоты
- •IX.2.5.1. Производные формулы X-co-y
- •IX.2.5.3. Производные с кумулированными двойными связями.
Гидразиды
Гидразиды карбоновых кислот – ацилированные гидразин или его замещенные. Различают моноацилгидразины (простые гидразиды) (653), 1,1- диацилгидразины (654), 1,2-диацилгидразины (655), три- и тетраацилгидразины:
Г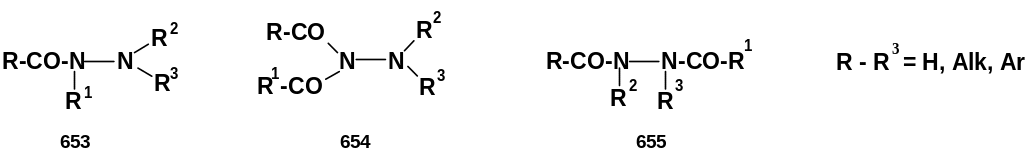 идразиды
могут быть также циклическими.
идразиды
могут быть также циклическими.
Для получения гидразидов чаще всего используют ацилирование гидразина или его замещенных (алкил- или арилгидразинов) производными карбоновых кислот типа R-CO-X – хлорангидридами, ангидридами, сложными эфирами, амидами (если в этих реакциях субстратами считать упомянутые производные – то это реакции гидразинолиза данных производных):
Г идразин
и алкилгидразины – сильные
нуклеофилы,
заметно более сильные, чем аммиак и
амины; поэтому они ацилируются легче.
Для получения моноацилгидразинов
лучше всего использовать достаточно
слабые ацилирующие реагенты – сложные
эфиры; более активные реагенты –
хлорангидриды и ангидриды карбоновых
кислот – лучше использовать для получения
ди-, три- и
тетраацилгидразинов.
идразин
и алкилгидразины – сильные
нуклеофилы,
заметно более сильные, чем аммиак и
амины; поэтому они ацилируются легче.
Для получения моноацилгидразинов
лучше всего использовать достаточно
слабые ацилирующие реагенты – сложные
эфиры; более активные реагенты –
хлорангидриды и ангидриды карбоновых
кислот – лучше использовать для получения
ди-, три- и
тетраацилгидразинов.
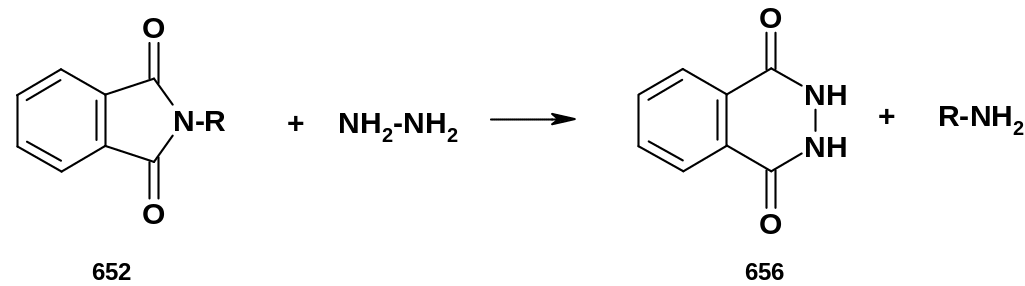 Гидразинолизу
подвергаются также и амиды. В частности,
в химии белка используется гидразинолиз
пептидных связей гидразином при 100
оС для
определения С-концов пептидных цепей.
Имиды, более активные, чем амиды,
подвергаются гидразинолизу легко; в
частности, N-алкилфталимиды
(652), получаемые в методе Габриэля, легко
расщепляются гидразином c
образованием циклического 1,2-диацилгидразина
(656) и первичных аминов: Этот вариант
часто предпочитают кислотному или
щелочному гидролизу.
Гидразинолизу
подвергаются также и амиды. В частности,
в химии белка используется гидразинолиз
пептидных связей гидразином при 100
оС для
определения С-концов пептидных цепей.
Имиды, более активные, чем амиды,
подвергаются гидразинолизу легко; в
частности, N-алкилфталимиды
(652), получаемые в методе Габриэля, легко
расщепляются гидразином c
образованием циклического 1,2-диацилгидразина
(656) и первичных аминов: Этот вариант
часто предпочитают кислотному или
щелочному гидролизу.
Химические свойства гидразидов удобнее всего рассмотреть на примере простых незамещенных моноацилгидразинов (гидразидов карбоновых кислот) R-CO-NH-NH2; именно они проявляют наибольшую специфику.
По структуре гидразиды напоминают амиды, и ряд их химических свойств напоминает свойства амидов - прежде всего, нуклеофильные реакции карбонильной группы, протекающие столь же вяло, как и для амидов. Специфика гидразидов связана с появлением дополнительного атома азота; неподеленная электронная пара этого атома не сопряжена с карбонильной группой и, следовательно, не делокализована. Поэтому гидразиды являются гораздо более сильными основаниями и нуклеофилами, чем амиды. Основность и нуклеофильность простых гидразидов меньше, чем самого гидразина (за счет –I-эффекта ацильной группы), но вполне достаточны для протекания ряда реакций, аналогичных реакциям первичных аминов:
Р еакция
1 –
протонирование; при взаимодействии с
кислотами образуются обычные аммонийные
соли.
еакция
1 –
протонирование; при взаимодействии с
кислотами образуются обычные аммонийные
соли.
Реакция 2 – алкилирование; здесь гидразиды выступают как нуклеофильные реагенты в реакциях (обычно SN2) c галогенидами или тозилатами.
Реакция 3 – ацилирование; происходит при взаимодействии с галогенангидридами или ангидридами карбоновых кислот; образуются более ацилированные гидразины, в первую очередь, 1,2-диацилгидразины.
Реакция 4 – взаимодействие с карбонильными соединениями; образуются N-ацилгидразоны карбонильных соединений; реакция аналогична образованию обычных гидразонов и арилгидразонов. N-Ацилгидразоны образуются легко, хорошо кристаллизуются; довольно часто они малорастворимы, что дает возможность выделять карбонильные соединения из смесей; после выделения карбонильные соединения регенерируют путем гидролиза ацилгидразонов.
Реакция 5 – нитрозирование; оно происходит при действии азотистой кислоты (смеси нитрита натрия и минеральной кислоты); и здесь гидразиды ведут себя аналогично первичным аминам. Продуктами реакции являются азиды карбоновых кислот (ацилазиды); их также можно отнести к производным типа R-CO-X. Группа N3 называется азидогруппой. Строение азидов можно выразить несколькими резонансными структурами (657’)-(657'''):
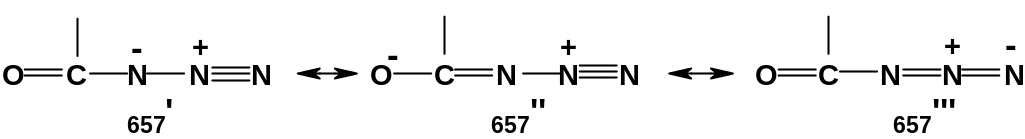 Азиды
– достаточно малостабильные соединения;
для них характерна тенденция к выбросу
молекулы азота – это термодинамически
выгодно. Разложение азидов с отщеплением
азота обычно происходит термически.
При нагревании азидов карбоновых кислот
в водных растворах происходит распад
с образованием азота, оксида углерода
(IV)
и первичного
амина.
Азиды
– достаточно малостабильные соединения;
для них характерна тенденция к выбросу
молекулы азота – это термодинамически
выгодно. Разложение азидов с отщеплением
азота обычно происходит термически.
При нагревании азидов карбоновых кислот
в водных растворах происходит распад
с образованием азота, оксида углерода
(IV)
и первичного
амина.
R-CO-N3 + HOH R-NH2 + N2 + CO2
Р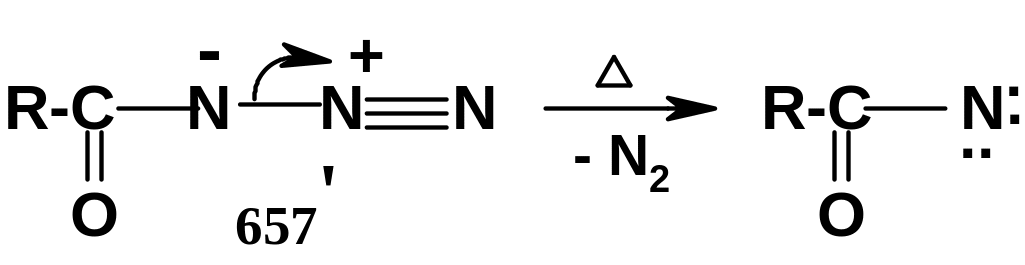 еакция
называется перегруппировкой
Курциуса и,
наряду с перегруппировкой Гофмана,
используется для получения первичных
аминов. Механизм перегруппировки
Курциуса в основной части аналогичен
перегруппировке Гофмана – и здесь
промежуточной частицей можно считать
нитрен:
еакция
называется перегруппировкой
Курциуса и,
наряду с перегруппировкой Гофмана,
используется для получения первичных
аминов. Механизм перегруппировки
Курциуса в основной части аналогичен
перегруппировке Гофмана – и здесь
промежуточной частицей можно считать
нитрен:
Образование нитрена нагляднее всего можно представить как результат отщепления азота от резонансной структуры (657’); дальнейшие превращения те же, что и при перегруппировке Гофмана. В отличие от перегруппировки Гофмана, здесь можно выделить изоцианаты – если проводить термолиз в безводной среде.
