
- •IX.2. Производные карбоновых кислот
- •IX.2.1. Производные формулы r-co-X
- •IX.2.1.1. Галогенангидриды карбоновых кислот (ацилгалогениды).
- •IX.2.1.2. Ангидриды карбоновых кислот.
- •IX.2.1.3. Сложные эфиры
- •Химические свойства
- •I. Нуклеофильные реакции карбонильной группы.
- •II. Реакции расщепления связи о-алкил.
- •III. Восстановление сложных эфиров.
- •Ацилоиновая конденсация
- •IV. Реакции пиролитического отщепления.
- •IX.2.1.4. Амиды и родственные соединения
- •Гидразиды
- •Гидроксамовые кислоты
- •IX.2.2.1. Имидоэфиры
- •IX.2.2.2. Амидины
- •IX.2.3. Ортоэфиры и ацетали амидов
- •IX.2.3.1. Ортоэфиры
- •IX.2.3.2. Ацетали амидов
- •IX.2.4. Кетены и нитрилы.
- •IX.2.4.1. Кетены
- •1. Взаимодействие с нуклеофильными реагентами.
- •IX.2.4.2. Нитрилы
- •IX.2.5. Производные угольной кислоты
- •IX.2.5.1. Производные формулы X-co-y
- •IX.2.5.3. Производные с кумулированными двойными связями.
IX.2.1.3. Сложные эфиры
Сложные эфиры чаще всего получают ацилированием гидроксипроизводных карбоновыми кислотами, их хлорангидридами и ангидридами, а также кетенами (см. ниже); достаточно широко используется взаимодействие солей карбоновых кислот с галогенидами и тозилатами по SN2-механизму (стр. 318). Из других способов можно отметить присоединение карбоновых кислот к ацетилену (стр. 113), перегруппировку Байера-Виллигера (стр. 256), реакцию Тищенко (стр.261). Для получения метиловых эфиров используют реакцию карбоновых кислот с диазометаном (будет рассмотрено позднее).
Названия сложных эфиров R-CO-OR1 обычно складываются из названия радикала R1 и названия кислоты с прибавлением окончания ат: этиловый эфир уксусной кислоты – этилацетат; пропиловый эфир бензойной кислоты – пропилбензоат; диметиловый эфир щавелевой кислоты – диметилоксалат.
Химические свойства
Свойства сложных эфиров обнаруживают, с одной стороны, определенное сходство со свойствами ранее рассмотренных производных – хлорангидридов и ангидридов, с другой – заметное своеобразие; в частности, появляются новые типы реакций, такие, как ацилоиновая конденсация, пиролиз и другие.
Химические реакции сложных эфиров можно разделить на следующие группы: I. Нуклеофильные реакции карбонильной группы; II. Реакции расщепления связи О-алкил; III. Реакции восстановления; IV. Реакции пиролитического отщепления. Весьма важные реакции положения отдельно не рассматриваются; часть материала (сложноэфирная конденсация) будет рассмотрена в разделе «Нуклеофильные реакции карбонильной группы», а часть – в специальном разделе, посвященном метиленактивным соединениям.
I. Нуклеофильные реакции карбонильной группы.
Наиболее характерными реакциями этой группы являются взаимодействие сложных эфиров с О- и N-нуклеофилами и металлорганическими соединениями, а также реакции конденсации с карбанионами.
Сложные эфиры, как и предыдущие типы производных, подвергаются гидролизу и ацилируют О- и N-нуклеофилы по общей схеме:
![]() Для
группы –OR2
донорный +М-эффект заметно превосходит
акцепторный –I-эффект,
поэтому карбонильная группа сложных
эфиров относительно малоактивна по
отношению к нуклеофилам (примерно на
уровне активности карбонильной группы
самих карбоновых кислот). Сложные эфиры
не относятся к активным ацилирующим
реагентам; при взаимодействии со слабыми
нуклеофилами (вода, спирты) требуется
катализ.
Для
группы –OR2
донорный +М-эффект заметно превосходит
акцепторный –I-эффект,
поэтому карбонильная группа сложных
эфиров относительно малоактивна по
отношению к нуклеофилам (примерно на
уровне активности карбонильной группы
самих карбоновых кислот). Сложные эфиры
не относятся к активным ацилирующим
реагентам; при взаимодействии со слабыми
нуклеофилами (вода, спирты) требуется
катализ.
Гидролиз сложных эфиров проходит под действием водных растворов кислот или оснований (обычно щелочей). Гидролиз с кислотным катализом приводит к образованию соответствующих карбоновой кислоты и спирта; механизмы гидролиза обратны механизмам кислотно-катализируемой этерификации; в зависимости от строения эфиров и условий это могут быть механизмы ААС2 или ААС1 (см. стр.317, 318). Гидролиз под действием щелочей, естественно, приводит к образованию солей карбоновых кислот:
R1CO-OR2 + Na+OH¯ R1-CO-O¯Na+ + R2-OH
Механизм здесь иной: это типичный механизм взаимодействия производных карбоновых кислот с анионными нуклеофилами (был рассмотрен выше на примере ацилгалогенидов). В данном случае он выглядит так:
В начале
происходит присоединение анионного
нуклеофила – гидроксид-аниона, затем
– выталкивание алкоксид-аниона, который,
естественно, депротонирует возникающую
при этом кислоту с образованием спирта
и более устойчивого карбоксилат-аниона.
Поскольку скоростьопределяющая стадия
здесь бимолекулярна,
механизм обозначается как BAС2,
т.е. бимолекулярная реакция ацильных
производных, катализируемая основаниями
(B
– Base).
В отличие от кислотного гидролиза,
щелочной гидролиз практически
необратим,
т.к. соли карбоновых кислот пассивны по
отношению к нуклеофилам.
начале
происходит присоединение анионного
нуклеофила – гидроксид-аниона, затем
– выталкивание алкоксид-аниона, который,
естественно, депротонирует возникающую
при этом кислоту с образованием спирта
и более устойчивого карбоксилат-аниона.
Поскольку скоростьопределяющая стадия
здесь бимолекулярна,
механизм обозначается как BAС2,
т.е. бимолекулярная реакция ацильных
производных, катализируемая основаниями
(B
– Base).
В отличие от кислотного гидролиза,
щелочной гидролиз практически
необратим,
т.к. соли карбоновых кислот пассивны по
отношению к нуклеофилам.
 Гидролиз
циклических эфиров – лактонов – приводит
к образованию гидроксикислот (при
кислотном гидролизе) или их солей (при
щелочном гидролизе):
Гидролиз
циклических эфиров – лактонов – приводит
к образованию гидроксикислот (при
кислотном гидролизе) или их солей (при
щелочном гидролизе):
Ацилирование спиртов сложными эфирами приводит к образованию новых сложных эфиров со спиртами-реагентами с вытеснением «исходных» спиртов:
R-CO-OR1 + R2-OH R-CO-OR2 + R1-OH
Э ту
реакцию иначе называют переэтерификацией
(иногда,
особенно в биохимии, используется термин
«трансэстерификация») или алкоголизом
сложных эфиров (по аналогии с гидролизом).
Реакция протекает обычно при кислотном
катализе по механизму AAС2:
ту
реакцию иначе называют переэтерификацией
(иногда,
особенно в биохимии, используется термин
«трансэстерификация») или алкоголизом
сложных эфиров (по аналогии с гидролизом).
Реакция протекает обычно при кислотном
катализе по механизму AAС2:
Механизм полностью аналогичен механизму этерификации (стр. 317). Реакция микроскопически обратима и ее можно сдвинуть как в одну, так и в другую сторону, используя избыток R2-OH либо R1OH; обычно избыточный спирт используют в качестве растворителя.
![]() Переэтерификация
происходит и при действии на сложные
эфиры алкоголятов других спиртов:
Переэтерификация
происходит и при действии на сложные
эфиры алкоголятов других спиртов:
Реакция идет по механизму BAС2, аналогично щелочному гидролизу, с той разницей, что здесь не образуется соль кислоты, и реакция обратима.
Реакции переэтерификации используют как для синтеза, так и для расщепления сложных эфиров. В частности, метиловые эфиры природных жирных кислот (удобные формы для хромато-масс-спектрометрического анализа) можно получать из природных сложных эфиров этих кислот при обработке избытком метанола при катализе H2SO4. Алкоголиз используется при синтезе полиэфиров (будет рассмотрено позднее). Некоторые биохимические реакции также относятся к переэтерификации; в частности, так образуются в организме сложные эфиры холестерина.
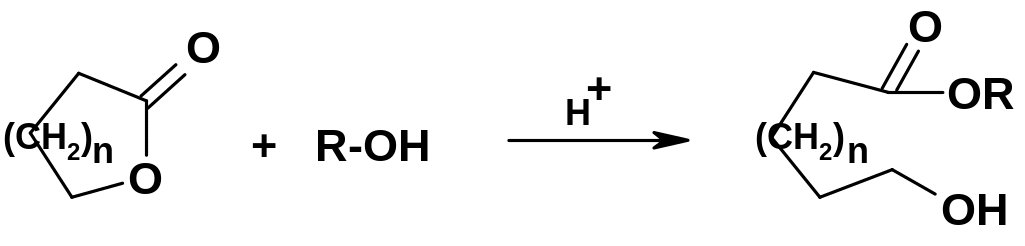 Алкоголиз лактонов
приводит к сложным эфирам гидроксикислот:
Алкоголиз лактонов
приводит к сложным эфирам гидроксикислот:
Помимо алкоголиза, существует еще один вариант переэтерификации – ацидолиз; это – обменная реакция с молекулой карбоновой кислоты, причем образуется эфир этой новой кислоты, а «старая» кислота вытесняется:
R-CO-OR1 + R2-CO-OH R-CO-OH + R2CO-OR1
 Ацилирование
N-нуклеофилов
сложными эфирами
приводит к образованию амидов
(при ацилировании аммиака, первичных и
вторичных аминов), гидразидов
(при ацилировании гидразина и его
замещенных), гидроксамовых
кислот (при
ацилировании гидроксиламина):
Ацилирование
N-нуклеофилов
сложными эфирами
приводит к образованию амидов
(при ацилировании аммиака, первичных и
вторичных аминов), гидразидов
(при ацилировании гидразина и его
замещенных), гидроксамовых
кислот (при
ацилировании гидроксиламина):
И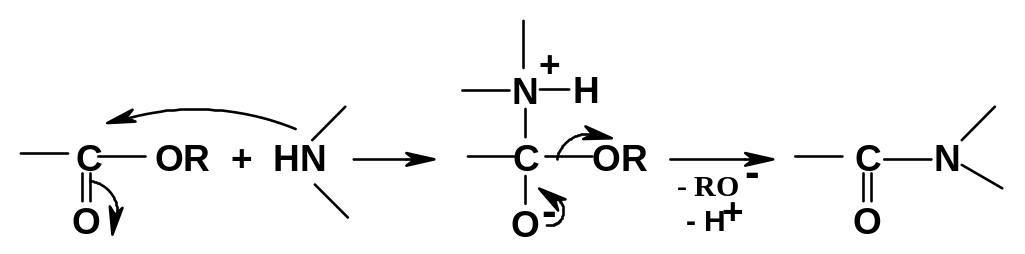 спользуемые
N-нуклеофилы
(особенно гидразин и гидроксиламин)
более активны, чем О-нуклеофилы, поэтому
их взаимодействие со сложными эфирами
может проходить без катализа, хотя в
ряде случаев используют основный или
кислотный катализ. Механизм некаталитического
взаимодействия - частный случай
механизмов реакций производных кислот
с реагентами типа H-Y:
спользуемые
N-нуклеофилы
(особенно гидразин и гидроксиламин)
более активны, чем О-нуклеофилы, поэтому
их взаимодействие со сложными эфирами
может проходить без катализа, хотя в
ряде случаев используют основный или
кислотный катализ. Механизм некаталитического
взаимодействия - частный случай
механизмов реакций производных кислот
с реагентами типа H-Y:
Для получения амидов ацилирование сложными эфирами используется реже, чем ацилирование хлорангидридами и ангидридами, но все же известно достаточно много примеров таких синтезов. Для получения гидразидов и гидроксамовых кислот ацилирование сложными эфирами является наилучшим методом, т.к. гидразин и гидроксиламин – сильные нуклеофилы, и при их взаимодействии с энергичными ацилирующими реагентами – ацилгалогенидами и ангидридами – реакции могут протекать слишком бурно и приводить к продуктам диацилирования, а для гидразина – также три- и тетраацилирования.
![]() Взаимодействие
сложных эфиров с металлорганическими
соединениями,
как и для ацилгалогенидов, может приводить
к кетонам или идти дальше – до образования
третичных спиртов. При взаимодействии
с литийалкилами реакцию можно в
определенных условиях остановить на
стадии образования кетона:
Взаимодействие
сложных эфиров с металлорганическими
соединениями,
как и для ацилгалогенидов, может приводить
к кетонам или идти дальше – до образования
третичных спиртов. При взаимодействии
с литийалкилами реакцию можно в
определенных условиях остановить на
стадии образования кетона:
П ри
взаимодействии с реактивами Гриньяра
реакция, как правило, не останавливается
на стадии образования кетона и идет
дальше, до образования третичного
спирта:
ри
взаимодействии с реактивами Гриньяра
реакция, как правило, не останавливается
на стадии образования кетона и идет
дальше, до образования третичного
спирта:
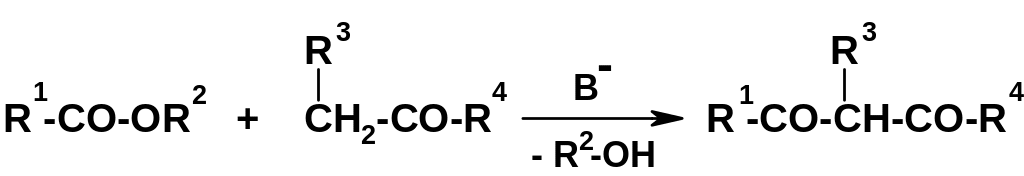 Реакции
конденсации с участием карбонильной
группы сложных эфиров
имеют большое препаративное значение.
Одна из них – конденсация
сложных эфиров с кетонами
(выступающими в роли метиленовой
компоненты):
Реакции
конденсации с участием карбонильной
группы сложных эфиров
имеют большое препаративное значение.
Одна из них – конденсация
сложных эфиров с кетонами
(выступающими в роли метиленовой
компоненты):
Реакция была рассмотрена ранее (стр. 248); в результате образуются 1,3-дикетоны, широко используемые в органическом синтезе.
Другая чрезвычайно важная реакция – конденсация двух молекул сложного эфира в присутствии сильного основания (сложноэфирная конденсация, которую часто называют конденсацией Клайзена). Продуктами реакции являются эфиры оксокарбоновых кислот:
Р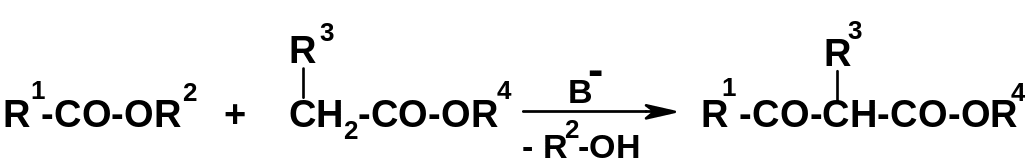
 еакция
аналогична предыдущей, с той разницей,
что в роли метиленовой компоненты
выступает не кетон, а вторая молекула
сложного эфира. Широко используется
вариант конденсации двух одинаковых
молекул сложного эфира (R1=CH2R3,
R2=R4),
т.е. самоконденсации сложных эфиров при
действии сильных оснований. Простейший
и известнейший пример – конденсация
двух молекул этилацетата с образованием
ацетоуксусного
эфира (622) –
одного из наиболее широко используемых
в органическом синтезе веществ:
еакция
аналогична предыдущей, с той разницей,
что в роли метиленовой компоненты
выступает не кетон, а вторая молекула
сложного эфира. Широко используется
вариант конденсации двух одинаковых
молекул сложного эфира (R1=CH2R3,
R2=R4),
т.е. самоконденсации сложных эфиров при
действии сильных оснований. Простейший
и известнейший пример – конденсация
двух молекул этилацетата с образованием
ацетоуксусного
эфира (622) –
одного из наиболее широко используемых
в органическом синтезе веществ:
В ряде случаев используют конденсацию
разных эфиров
(перекрестная конденсация); в этих
случаях необходимо, чтобы один из эфиров
(карбонильная компонента) не содержал
-метиленовой
группы и при этом его карбонильная
группа имела повышенную активность
(чтобы конкурентно подавить самоконденсацию
метиленовой компоненты). Таким эфиром,
в частности, является диэтиловый эфир
щавелевой кислоты (диэтилоксалат) (623),
один из типичных партнеров в реакциях
перекрестной конденсации:
ряде случаев используют конденсацию
разных эфиров
(перекрестная конденсация); в этих
случаях необходимо, чтобы один из эфиров
(карбонильная компонента) не содержал
-метиленовой
группы и при этом его карбонильная
группа имела повышенную активность
(чтобы конкурентно подавить самоконденсацию
метиленовой компоненты). Таким эфиром,
в частности, является диэтиловый эфир
щавелевой кислоты (диэтилоксалат) (623),
один из типичных партнеров в реакциях
перекрестной конденсации:
 Важным
частным случаем сложноэфирной конденсации
является внутримолекулярная
конденсация
сложных эфиров дикарбоновых кислот;
при этом замыкается карбоциклическая
структура; образуется 2-алкоксикарбонильное
производное циклического кетона:
Важным
частным случаем сложноэфирной конденсации
является внутримолекулярная
конденсация
сложных эфиров дикарбоновых кислот;
при этом замыкается карбоциклическая
структура; образуется 2-алкоксикарбонильное
производное циклического кетона:
Этот вариант часто называют конденсацией Дикмана; наиболее успешно она протекает при образовании 5- и 6- членных циклов (n=3, 4). Конденсация Дикмана – один из классических методов карбоциклизации.
Для проведения сложноэфирной конденсации необходимо использовать сильное основание, ибо только с его помощью можно генерировать карбанион из -положения сложного эфира (положение сложных эфиров имеет меньшую СН-кислотность, чем положение карбонильных соединений, т.к. группа COOR является менее электроноакцепторной, чем карбонильная группа альдегидов и кетонов). Наиболее часто в качестве основания используют алкоголят того спирта, который образует исходный сложный эфир [если использовать алкоголят другого спирта, реакция будет осложняться переэтерификацией (см. выше)]. Иногда используют амиды металлов, а в отдельных случаях такое супероснование, как фениллитий. Механизм сложноэфирной конденсации вполне аналогичен рассмотренному ранее механизму конденсации сложных эфиров с кетонами:
Здесь сочетаются механизм, аналогичный альдольной конденсации (образование карбаниона и его атака на карбонильную группу), и механизм типа BAС2 (внутримолекулярное вытеснение алкоксид-аниона).
