
- •Глава VIII. Углеводы
- •VIII.1. Моносахариды
- •VIII.1.1. Стереоизомерия открытых форм моносахаридов; d- и l-ряды.
- •VIII.1.2. Кольчато-цепная таутомерия моносахаридов.
- •VIII.1.3. Химические свойства моносахаридов
- •VIII.1. 3.1. Реакции гидроксигрупп моносахаридов
- •1. Образование ацеталей (гликозидов).
- •2 . Образование аминоацеталей (n-гликозидов).
- •1. Синтез простых эфиров(алкилирование).
- •3. Образование сложных эфиров.
- •VIII.1.3.2. Реакции карбонильной группы.
- •1.Взаимодействие с фенилгидразином. Озазоны.
- •3. Взаимодействие с другими нуклеофилами.
- •VII.1.3.3. Реакции окисления и восстановления
- •Получение альдоновых кислот.
- •2. Получение гликаровых (сахарных) кислот.
- •3. Образование гликуроновых кислот.
- •4 . Деструктивное окисление.
- •VIII.1.3.4. Некоторые превращения в ряду моносахаридов.
- •Получение высших полисахаридов из низших
- •VIII.1.4. Некоторые моносахариды с модифицированной структурой
- •VIII.2. Олигосахариды
- •VIII.2.1. Дисахариды
- •VIII.2.2. Высшие олигосахариды
- •VIII.3. Полисахариды
3. Взаимодействие с другими нуклеофилами.
Карбонильные группы открытых форм моносахаридов реагируют с широким кругом других нуклеофилов (см. раздел «Карбонильные соединения»); некоторые из этих реакций используются в практической химии углеводов, в частности, присоединение HCN, образование оксимов, тиоацеталей и другие; некоторые примеры такого использования будут приведены ниже.
VII.1.3.3. Реакции окисления и восстановления
А. Реакции окисления.
Реакции окисления моносахаридов достаточно многообразны; в зависимости от окислителя и условий реакций можно получать различные продукты окисления.
Получение альдоновых кислот.
При действии на альдозы мягких окислителей альдегидная группа окисляется до карбоксильной; другие группы не затрагиваются. Полученные полигидроксикарбоновые кислоты называются альдоновыми (гликоновыми); довольно часто образуются не сами альдоновые кислоты, а их внутримолекулярные сложные эфиры – лактоны:
Н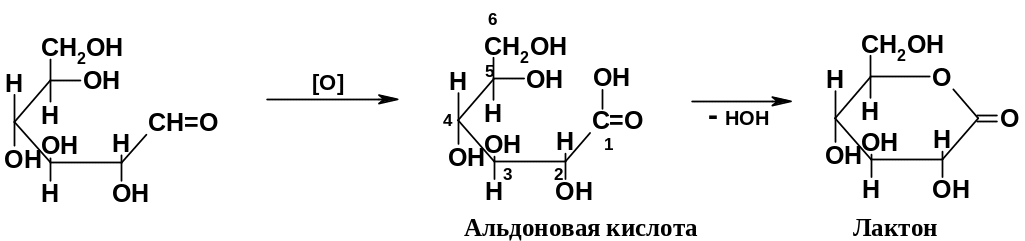 аряду
с 6-членными лактонами (лактонами)
образуются и 5-членные лактоны),
где задействована группа ОН при С4.
аряду
с 6-членными лактонами (лактонами)
образуются и 5-членные лактоны),
где задействована группа ОН при С4.
Наиболее типичный окислитель в этих реакциях – бромная вода; можно использовать также реактив Фелинга (смеcь сульфата меди и виннокислого калия-натрия, окислитель – ион Сu2+) и реактив Толленса ( аммиачный раствор оксида серебра, окислитель – ион Ag+). Реактивы Фелинга и Толленса можно использовать для проведения качественных проб на сахара: при использовании реактива Фелинга выпадает красный осадок Сu2O, а реактива Толленса – осадок металлического серебра (широко известная реакция серебряного зеркала). Эти качественные реакции дают не только альдозы, но и кетозы, например, фруктоза; причина в том, что оба этих реактива содержат основания, под действием которых фруктоза частично превращается в глюкозу и маннозу по реакции Лобри де Брюина – ван Экенштайна (см. выше). В то же время бромная вода кетозы не окисляет.
2. Получение гликаровых (сахарных) кислот.
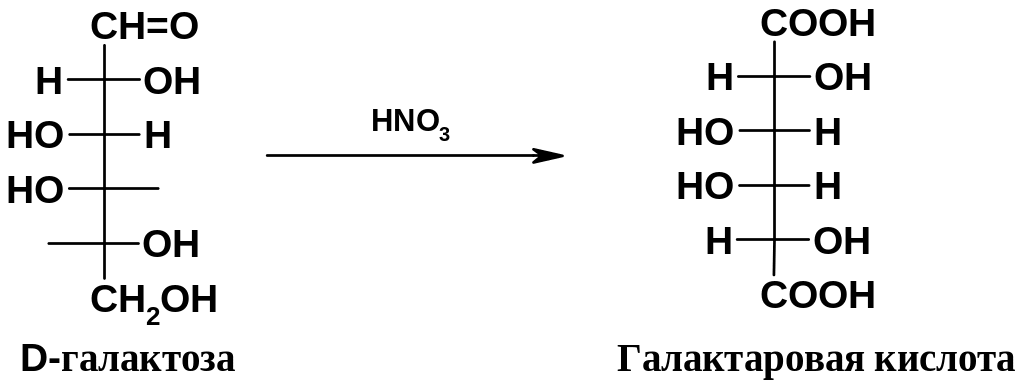 При
действии на альдозы
более
сильных
окислителей, например, азотной кислоты,
окисляется не только альдегидная группа,
но и находящаяся на другом конце молекулы
группа СН2ОН;
образуются двухосновные (дикарбоновые)
кислоты, называемые гликаровыми
(иногда их называют просто аровыми) или
сахарными:
При
действии на альдозы
более
сильных
окислителей, например, азотной кислоты,
окисляется не только альдегидная группа,
но и находящаяся на другом конце молекулы
группа СН2ОН;
образуются двухосновные (дикарбоновые)
кислоты, называемые гликаровыми
(иногда их называют просто аровыми) или
сахарными:
В отличие от моносахаридов, для сахарных кислот появляется возможность образования мезо-форм; в частности, при окислении D-галактозы образуется галактаровая кислота (имеющая также «симпатичное» тривиальное название – слизевая), которая оптически неактивна, поскольку имеет мезо-строение (плоскость симметрии проходит между атомами С3 и С4). Легко убедиться, что глюкаровая кислота, полученная при окислении D-глюкозы, не имеет плоскости симметрии и является оптически активной. Обнаружение оптической активности или, напротив, ее отсутствия для сахарных кислот, полученных при окислении моносахаридов, оказалось одним из эффективных приемов, использованных для установления пространственных конфигураций моносахаридов (Э.Фишер).
3. Образование гликуроновых кислот.
В природе достаточно широко распространены производные моносахаридов, у которых группа СН2ОН окислена до карбоксильной, в то время как карбонильная функция не затронута; такие производные называют гликуроновыми (в случае альдоз – альдуроновыми) или просто уроновыми кислотами. Альдуроновые кислоты легко образуют лактоны; в частности, производное D-глюкозы – D-глюкуроновая кислота (547), переходя в фуранозную циклическую форму (547’), далее образует 5-членный лактон – глюкурон (548):
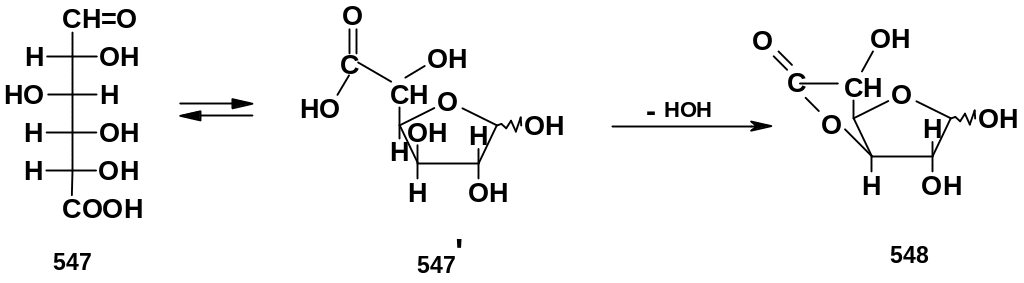 В
биологических условиях (in
vivo)
уроновые кислоты образуются при
ферментативном
окислении углеводов, а точнее их
производных. Получение уроновых кислот
в лабораторных условиях – более сложная
задача. Наиболее приемлемый метод –
окисление моносахаридов или лучше их
производных (гликозидов, 1,2-изопропилиденовых
производных) в присутствии платины. Для
окисления гликозидов можно использовать
бромноватистую кислоту. Например, при
окислении метилглюкозида (549) образуется
гликозид глюкуроновой кислоты (550); при
его кислотном гидролизе образуется
глюкуроновая кислота; здесь она
представлена в пиранозной форме (547’’);
затем она через открытую форму (547) может
переходить в фуранозную форму (547’) и
далее в лактон (548).
В
биологических условиях (in
vivo)
уроновые кислоты образуются при
ферментативном
окислении углеводов, а точнее их
производных. Получение уроновых кислот
в лабораторных условиях – более сложная
задача. Наиболее приемлемый метод –
окисление моносахаридов или лучше их
производных (гликозидов, 1,2-изопропилиденовых
производных) в присутствии платины. Для
окисления гликозидов можно использовать
бромноватистую кислоту. Например, при
окислении метилглюкозида (549) образуется
гликозид глюкуроновой кислоты (550); при
его кислотном гидролизе образуется
глюкуроновая кислота; здесь она
представлена в пиранозной форме (547’’);
затем она через открытую форму (547) может
переходить в фуранозную форму (547’) и
далее в лактон (548).
