
- •Глава VIII. Углеводы
- •VIII.1. Моносахариды
- •VIII.1.1. Стереоизомерия открытых форм моносахаридов; d- и l-ряды.
- •VIII.1.2. Кольчато-цепная таутомерия моносахаридов.
- •VIII.1.3. Химические свойства моносахаридов
- •VIII.1. 3.1. Реакции гидроксигрупп моносахаридов
- •1. Образование ацеталей (гликозидов).
- •2 . Образование аминоацеталей (n-гликозидов).
- •1. Синтез простых эфиров(алкилирование).
- •3. Образование сложных эфиров.
- •VIII.1.3.2. Реакции карбонильной группы.
- •1.Взаимодействие с фенилгидразином. Озазоны.
- •3. Взаимодействие с другими нуклеофилами.
- •VII.1.3.3. Реакции окисления и восстановления
- •Получение альдоновых кислот.
- •2. Получение гликаровых (сахарных) кислот.
- •3. Образование гликуроновых кислот.
- •4 . Деструктивное окисление.
- •VIII.1.3.4. Некоторые превращения в ряду моносахаридов.
- •Получение высших полисахаридов из низших
- •VIII.1.4. Некоторые моносахариды с модифицированной структурой
- •VIII.2. Олигосахариды
- •VIII.2.1. Дисахариды
- •VIII.2.2. Высшие олигосахариды
- •VIII.3. Полисахариды
VIII.1.3.2. Реакции карбонильной группы.
Это – реакции открытых форм сахаров. В принципе, это обычные реакции альдегидов и кетонов; однако наличие гидроксигрупп, особенно стоящих рядом с карбонильной, привносит в некоторые из этих реакций заметное своеобразие. В некоторых реакциях участвуют и карбонильная и гидрокси-группа; одна из таких реакций – образование внутримолекулярных полуацеталей – была рассмотрена выше.
1.Взаимодействие с фенилгидразином. Озазоны.
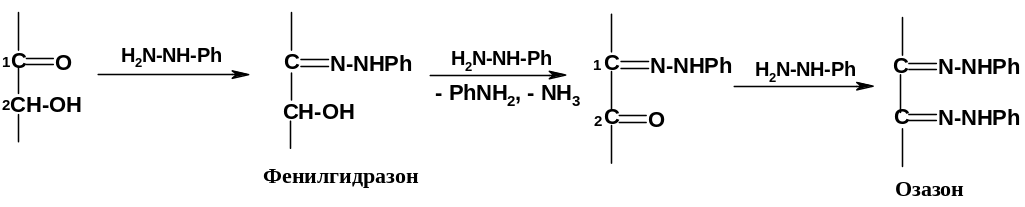 При
взаимодействии как альдоз, так и кетоз
с одним молем фенилгидразина образуются
обычные фенилгидразоны по карбонильной
группе; однако, если нагревать моносахариды
с
избытком
фенилгидразина, происходит окисление
соседней гидрокси-группы (при С2
у альдоз и при С1
у кетоз) до карбонильной, и образуются
бис-фенилгидразоны 1,2-дикарбонильных
соединений, которые обычно называются
озазонами.
Окислителем
является фенилгидразин,
который восстанавливается до анилина
и аммиака; формальная схема (но не
механизм!) выглядит следующим образом:
При
взаимодействии как альдоз, так и кетоз
с одним молем фенилгидразина образуются
обычные фенилгидразоны по карбонильной
группе; однако, если нагревать моносахариды
с
избытком
фенилгидразина, происходит окисление
соседней гидрокси-группы (при С2
у альдоз и при С1
у кетоз) до карбонильной, и образуются
бис-фенилгидразоны 1,2-дикарбонильных
соединений, которые обычно называются
озазонами.
Окислителем
является фенилгидразин,
который восстанавливается до анилина
и аммиака; формальная схема (но не
механизм!) выглядит следующим образом:
При окислении группы СНОН альдоз до группы С=О атом С2 теряет хиральность: поэтому моносахариды, эпимерные по С2, образуют один и тот же озазон; в ряду альдогексоз это, например, D-глюкоза и D-манноза, образующие озазон (545). Тот же озазон (545) образует и кетогексоза - D-фруктоза; в этом случае избыток фенилгидразина окисляет группу СН2ОН:
Р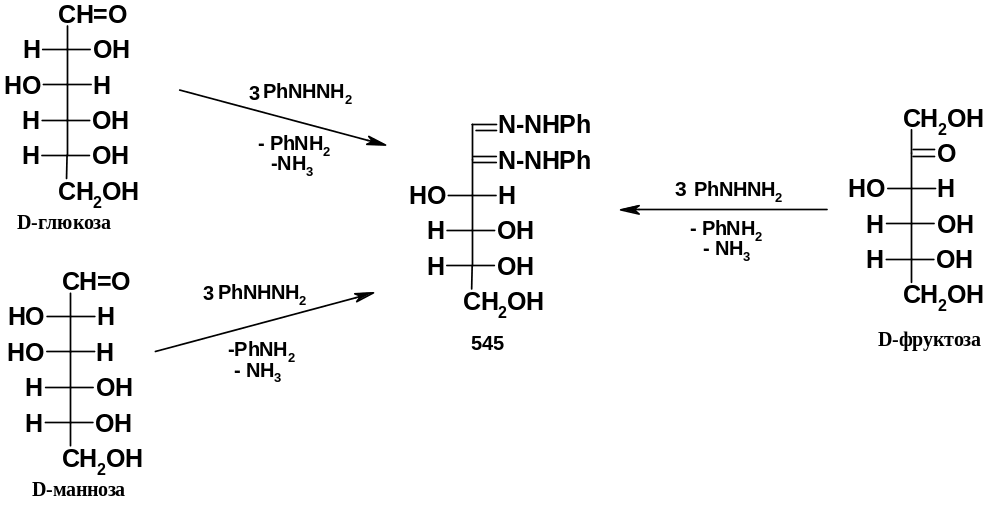 еакция
останавливается на образовании озазонов;
следующие группы СНОН уже не окисляются
избытком фенилгидразина. Озазоны –
устойчивые кристаллические вещества,
которые легко выделяются и очищаются
перекристаллизацией (в отличие от
монофенилгидразонов моносахаридов).
Они используются для характеристики
моносахаридов; в свое время образование
озазонов использовалось для нахождения
стереохимически родственных моносахаридов,
в частности, эпимеров по С2
для альдоз.
еакция
останавливается на образовании озазонов;
следующие группы СНОН уже не окисляются
избытком фенилгидразина. Озазоны –
устойчивые кристаллические вещества,
которые легко выделяются и очищаются
перекристаллизацией (в отличие от
монофенилгидразонов моносахаридов).
Они используются для характеристики
моносахаридов; в свое время образование
озазонов использовалось для нахождения
стереохимически родственных моносахаридов,
в частности, эпимеров по С2
для альдоз.

 2.
Кето-енольные
превращения моносахаридов. Эпимеризация
альдоз и изомеризация альдоза кетоза.
2.
Кето-енольные
превращения моносахаридов. Эпимеризация
альдоз и изомеризация альдоза кетоза.
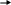 Открытые
формы моносахаридов, как и обычные
карбонильные соединения, содержащие
фрагменты СО-СН, могут подвергаться
енолизации в присутствии кислот и
оснований (кислоты и основания значительно
ускоряют взаимный переход кето- и
енольных форм). Енолизация альдоз и
кетоз в кислых и основных средах приводит
к изменению их структуры; эти изменения
довольно разнообразны и могут быть
достаточно глубокими (если сопровождаются
последующими реакциями). Наиболее
простой вариант – мягкие
Открытые
формы моносахаридов, как и обычные
карбонильные соединения, содержащие
фрагменты СО-СН, могут подвергаться
енолизации в присутствии кислот и
оснований (кислоты и основания значительно
ускоряют взаимный переход кето- и
енольных форм). Енолизация альдоз и
кетоз в кислых и основных средах приводит
к изменению их структуры; эти изменения
довольно разнообразны и могут быть
достаточно глубокими (если сопровождаются
последующими реакциями). Наиболее
простой вариант – мягкие
оснòвные условия (например, действие слабого основания – пиридина); здесь все ограничивается кето-енольными превращениями. Результатом является взаимное превращение эпимеров (эпимеризация), а также изомеризация альдоза кетоза. Эти превращения часто называют реакцией Лобри де Брюина – ван Экенштайна. Пример «из хрестоматии» - взаимопревращения D-глюкозы, D-маннозы и D-фруктозы:
П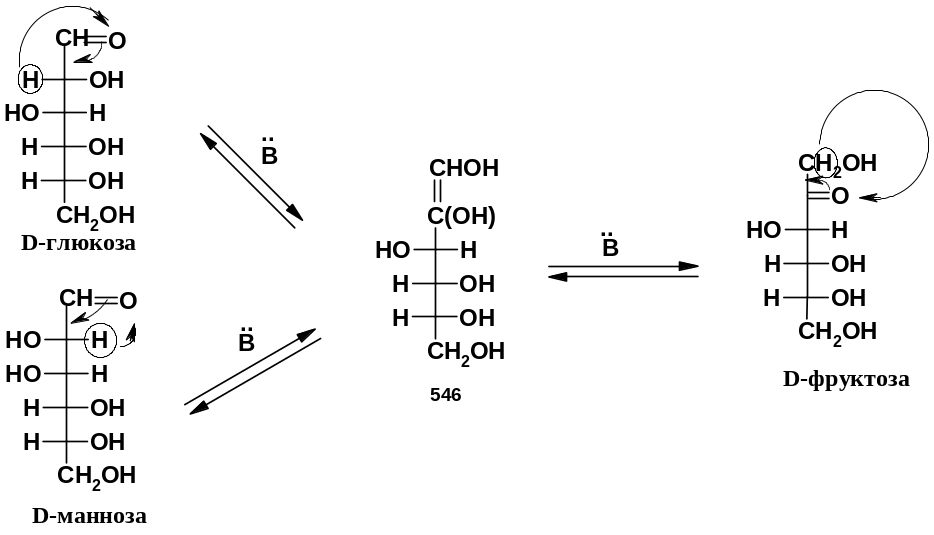 ромежуточная
ендиольная структура (546) – общая для
всех трех моносахаридов и может обратимо
превращаться в любой из них; поэтому в
системе устанавливается равновесие
между всеми тремя моносахаридами. Как
и рассмотренное выше образование одного
и того же озазона, данные превращения
подтверждают стереохимическое родство
этих моносахаридов – их одинаковую
конфигурацию по хиральным центрам С3
– С5.
ромежуточная
ендиольная структура (546) – общая для
всех трех моносахаридов и может обратимо
превращаться в любой из них; поэтому в
системе устанавливается равновесие
между всеми тремя моносахаридами. Как
и рассмотренное выше образование одного
и того же озазона, данные превращения
подтверждают стереохимическое родство
этих моносахаридов – их одинаковую
конфигурацию по хиральным центрам С3
– С5.
