
- •Глава VIII. Углеводы
- •VIII.1. Моносахариды
- •VIII.1.1. Стереоизомерия открытых форм моносахаридов; d- и l-ряды.
- •VIII.1.2. Кольчато-цепная таутомерия моносахаридов.
- •VIII.1.3. Химические свойства моносахаридов
- •VIII.1. 3.1. Реакции гидроксигрупп моносахаридов
- •1. Образование ацеталей (гликозидов).
- •2 . Образование аминоацеталей (n-гликозидов).
- •1. Синтез простых эфиров(алкилирование).
- •3. Образование сложных эфиров.
- •VIII.1.3.2. Реакции карбонильной группы.
- •1.Взаимодействие с фенилгидразином. Озазоны.
- •3. Взаимодействие с другими нуклеофилами.
- •VII.1.3.3. Реакции окисления и восстановления
- •Получение альдоновых кислот.
- •2. Получение гликаровых (сахарных) кислот.
- •3. Образование гликуроновых кислот.
- •4 . Деструктивное окисление.
- •VIII.1.3.4. Некоторые превращения в ряду моносахаридов.
- •Получение высших полисахаридов из низших
- •VIII.1.4. Некоторые моносахариды с модифицированной структурой
- •VIII.2. Олигосахариды
- •VIII.2.1. Дисахариды
- •VIII.2.2. Высшие олигосахариды
- •VIII.3. Полисахариды
VIII.1.3. Химические свойства моносахаридов
Как следует из их строения, моносахариды должны проявлять свойства гидроксисоединений (спиртов) и карбонильных соединений, а в циклической форме – также свойства полуацеталей (точнее – полуацетального гидроксила). При рассмотрении наиболее типичных свойств моносахаридов будет использована последовательность: I. Реакции гидроксигрупп; особое внимание будет уделено свойствам полуацетального гидроксила; II. Реакции карбонильной группы; III. Реакции окисления и восстановления. В заключение будут приведены некоторые достаточно простые примеры превращений моносахаридов, проходящих в несколько стадий.
VIII.1. 3.1. Реакции гидроксигрупп моносахаридов
А. Реакции полуацетальной гидроксигруппы
Одна из гидроксигрупп циклических форм моносахаридов обладает особыми свойствами – это полуацетальная гидроксигруппа, находящаяся при аномерном атоме углерода (при С1 у альдоз и при С2 у кетоз). Она заметно активнее остальных гидроксигрупп.
1. Образование ацеталей (гликозидов).
Пожалуй, важнейшая реакция этой «особой» группы – образование ацеталей при взаимодействии со спиртами; превращение полуацеталей в ацетали уже рассматривалось ранее (стр. 235). Реакции протекают при кислотном катализе в мягких условиях; остальные гидроксильные группы в эту реакцию не вступают. Таким образом, здесь протекает селективное моноалкилирование (образование простого эфира только по одной группе ОН).
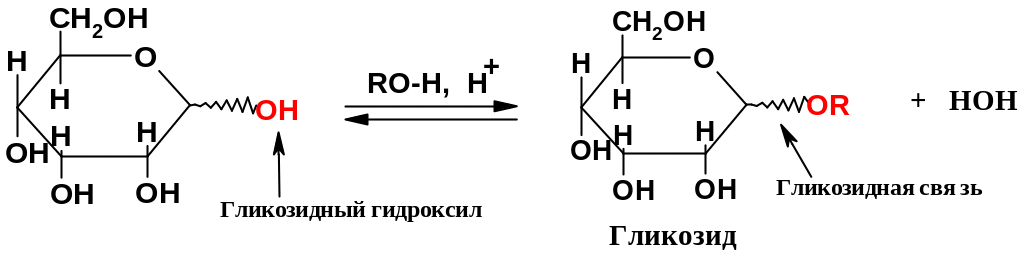 Образующиеся
ацетали моносахаридов называют
гликозидами
(точнее называть их О-гликозидами);
полуацетальный гидроксил в исходном
моносахариде часто называют гликозидным;
экзоциклическую связь С-О в гликозиде
называют гликозидной
связью.
Образующиеся
ацетали моносахаридов называют
гликозидами
(точнее называть их О-гликозидами);
полуацетальный гидроксил в исходном
моносахариде часто называют гликозидным;
экзоциклическую связь С-О в гликозиде
называют гликозидной
связью.
Гликозиды образуют и альдозы и кетозы – как в пиранозных, так и в фуранозных формах, как так ианомеры; полученные гликозиды также могут иметь как так иконфигурации (использованная в формулах «зигзагообразная» связь при С1 обозначает, что конфигурация при аномерном атоме может быть любой).Спирт ROH, участвующий в образовании гликозида, называют агликоном.
Название гликозида складывается из названия радикала агликона и названия исходного моносахарида с прибавлением окончания «озид». Например, представленный выше гликозид на основе D- аллозы, если он имеет -конфигурацию и R=CH3, имеет название метил--D-аллопиранозид [естественно, гликозиды маннозы называются маннозидами, глюкозы - глюкозидами и т.д.; не следует путать сходно звучащие термины «гликозиды» и «глюкозиды»: вторые – частный случай первых].
При образовании гликозидов условия таковы, что для исходного моносахарида наблюдается обратимый переход между открытой и всеми возможными циклическими формами – пиранозными и фуранозными; все циклические формы в обеих аномерных конфигурациях могут образовывать гликозиды. Процесс образования гликозидов также обратим, так что в конечном счете образуется равновесная смесь гликозидов с разным размером цикла и в разных аномерных формах. Общая закономерность – гликозиды фуранозных форм образуются быстрее, чем пиранозных, но гликозиды пиранозных форм более устойчивы. Поэтому при непродолжительном протекании реакции доминируют фуранозиды, в дальнейшем их концентрация уменьшается, и по достижении равновесия доминируют пиранозиды.
Что касается пространственной конфигурации образующихся пиранозидов, то здесь сказывается аномерный эффект: его суть заключается в том, что более термодинамически устойчивым становится аномер с аксиальным расположением заместителя при С1, т.е. -аномер. Причина аномерного эффекта – диполь-дипольное взаимодействие гликозидной связи С-О и неподеленных пар электронов у циклического атома кислорода:
Д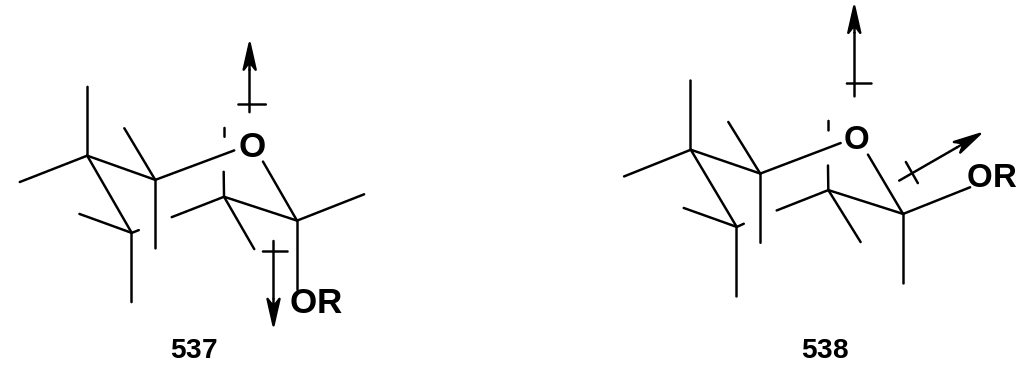 ействительно,
у структуры (537) с аксиальным заместителем
OR
диполи, образуемые атомом кислорода и
связью С-O(R),
антипараллельны,
что соответствует притяжению,
в то время как у структуры (538) с
экваториальным заместителем диполи
параллельны
(на рисунке это отражено неточно), что
соответствует отталкиванию.
ействительно,
у структуры (537) с аксиальным заместителем
OR
диполи, образуемые атомом кислорода и
связью С-O(R),
антипараллельны,
что соответствует притяжению,
в то время как у структуры (538) с
экваториальным заместителем диполи
параллельны
(на рисунке это отражено неточно), что
соответствует отталкиванию.
Для исходных моносахаридов (ОН вместо OR) действие аномерного эффекта во многом нейтрализуется сольватацией растворителем (экваториальная группа ОН сольватируется лучше аксиальной) и поэтому, например, для D-глюкозы преобладает -изомер (см. выше). Для гликозидов аномерный эффект сказывается сильнее, потому что группа OR сольватируется слабее, чем группа ОН; поэтому, например, для метилглюкопиранозида в равновесной смеси преобладает уже -изомер. Действие аномерного эффекта тем сильнее, чем менее полярным является растворитель.
Получение гликозидов непосредственно из моносахаридов – не единственный и далеко не лучший способ их синтеза – прежде всего, из-за стереохимических проблем. Более эффективными являются способы получения гликозидов не из самих моносахаридов, а из некоторых их производных, в частности, из ацилгликозилгалогенидов (см. ниже).
Особый аспект – ферментативный синтез гликозидов; он идет строго стереоселективно; одни ферменты катализируют образование только -, а другие – только -гликозидов.
Гликозиды не способны к кольчато-цепной таутомерии, т.к. у них отсутствует атом водорода, способный к миграции; следовательно, для них не наблюдается мутаротации.
При действии водных растворов кислот гликозиды гидролизуются с образованием моносахарида и агликона по реакции, обратной их образованию; в щелочных растворах гликозиды не гидролизуются (как и все ацетали). Гидролиз гликозидов катализируется также ферментами – теми же, что и их синтез; при этом одни ферменты (например, гликозидаза из дрожжей) гидролизуют только -гликозиды, другие (например, эмульсин из миндаля) – только -гликозиды. Это позволяет достаточно легко определить, каким аномером является тот или иной гликозид.
Гликозиды – вероятно, важнейшие из производных углеводов. По принципу гликозидов построены олиго- и полисахариды. Целый ряд гликозидов встречается в природе; один из простейших природных гликозидов – арбутин (539) - производное D-глюкозы, агликоном здесь является двухатомный фенол – гидрохинон; гликозид представляет собой -аномер:
Е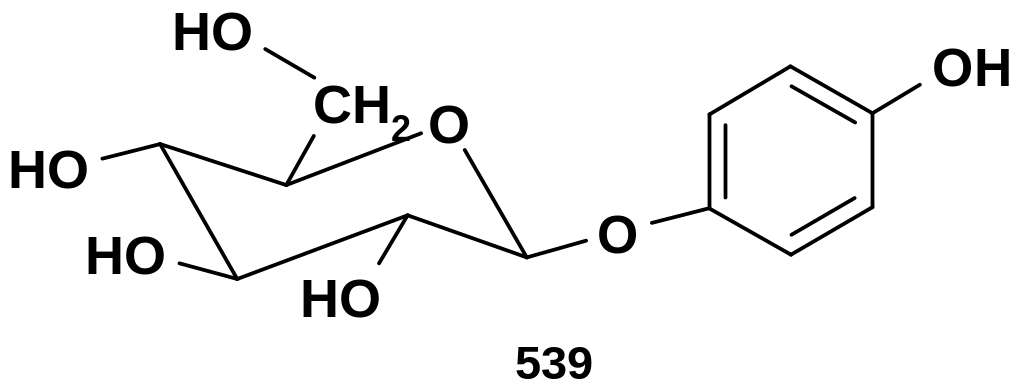 ще
большее значение имеют природные
гликозиды на основе олигосахаридов
(см. ниже).
ще
большее значение имеют природные
гликозиды на основе олигосахаридов
(см. ниже).
