
- •Глава VIII. Углеводы
- •VIII.1. Моносахариды
- •VIII.1.1. Стереоизомерия открытых форм моносахаридов; d- и l-ряды.
- •VIII.1.2. Кольчато-цепная таутомерия моносахаридов.
- •VIII.1.3. Химические свойства моносахаридов
- •VIII.1. 3.1. Реакции гидроксигрупп моносахаридов
- •1. Образование ацеталей (гликозидов).
- •2 . Образование аминоацеталей (n-гликозидов).
- •1. Синтез простых эфиров(алкилирование).
- •3. Образование сложных эфиров.
- •VIII.1.3.2. Реакции карбонильной группы.
- •1.Взаимодействие с фенилгидразином. Озазоны.
- •3. Взаимодействие с другими нуклеофилами.
- •VII.1.3.3. Реакции окисления и восстановления
- •Получение альдоновых кислот.
- •2. Получение гликаровых (сахарных) кислот.
- •3. Образование гликуроновых кислот.
- •4 . Деструктивное окисление.
- •VIII.1.3.4. Некоторые превращения в ряду моносахаридов.
- •Получение высших полисахаридов из низших
- •VIII.1.4. Некоторые моносахариды с модифицированной структурой
- •VIII.2. Олигосахариды
- •VIII.2.1. Дисахариды
- •VIII.2.2. Высшие олигосахариды
- •VIII.3. Полисахариды
VIII.1.2. Кольчато-цепная таутомерия моносахаридов.
Все приведенные выше соображения относятся к моносахаридам, имеющим структуру полигидроксикарбонильных соединений с открытой цепью. Как уже упоминалось (стр. 236), для игидроксикарбонильных соединений характерно весьма легкое образование внутримолекулярных 5- и 6-членных циклических полуацеталей. Поскольку моносахариды, начиная с альдотетроз, содержат в открытой форме гидроксигруппы в -положении по отношению к карбонильной группе (альдотетрозы и кетопентозы) или и в и в-положениях(все остальные), для них возникает возможность образования внутримолекулярных полуацеталей – и эта возможность реализуется в полной мере – как для альдоз, так и для кетоз.
Ниже представлены возможные направления образования внутримолекулярных полуацеталей на примере одних из наиболее распространенных типов моносахаридов - альдогексоз и кетогексоз:
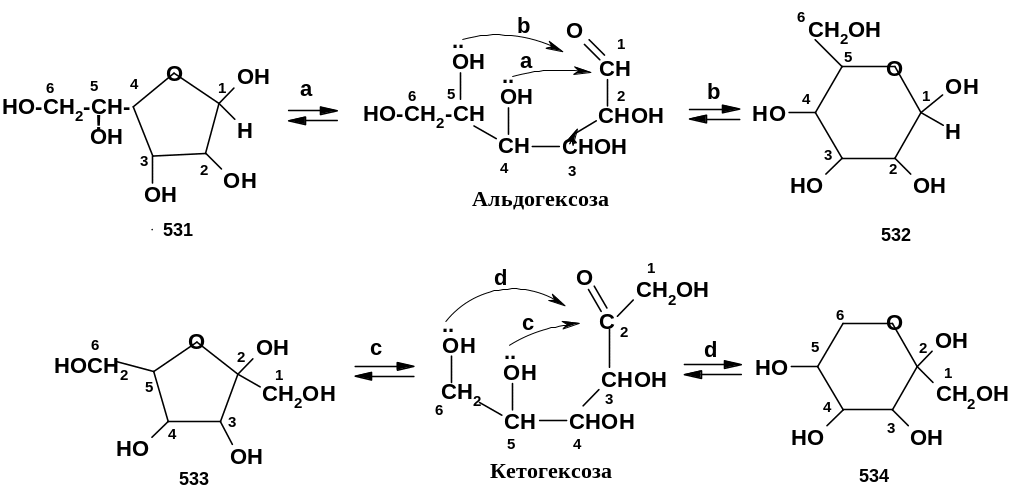 Поскольку
в данных полисахаридах гидроксигруппы
находятся как в -,
так и в -положениях
относительно карбонильной группы, здесь
возможно образование как 5-членных
[(531), (533)], так и 6-членных [(532), (534)] циклических
полуацеталей. В первом случае роль
внутреннего нуклеофила, присоединяющегося
по карбонильной группе, выполняет группа
ОН в положении 4 альдогексоз (а) или в
положении 5 кетогексоз (с); во втором
случае эту роль выполняет группа ОН в
положении 5 альдогексоз (b)
или в положении 6 кетогексоз (d).
Поскольку
в данных полисахаридах гидроксигруппы
находятся как в -,
так и в -положениях
относительно карбонильной группы, здесь
возможно образование как 5-членных
[(531), (533)], так и 6-членных [(532), (534)] циклических
полуацеталей. В первом случае роль
внутреннего нуклеофила, присоединяющегося
по карбонильной группе, выполняет группа
ОН в положении 4 альдогексоз (а) или в
положении 5 кетогексоз (с); во втором
случае эту роль выполняет группа ОН в
положении 5 альдогексоз (b)
или в положении 6 кетогексоз (d).
Внутримолекулярные полуацетали являются циклическими формами моносахаридов; структуры с 5-членными циклами называют фуранозными формами, а с 6-членными циклами – пиранозными формами. [Эти названия происходят от названий наиболее типичных гетероциклов: 5-членного с одним атомом кислорода – фурана и 6-членного с одним атомом кислорода – пирана; они будут рассмотрены в разделе «Гетероциклические соединения»].
Нетрудно заметить, что циклические формы моносахаридов изомерны открытым. Таким образом, для абсолютного большинства моносахаридов характерна кольчато-цепная изомерия, т.е. возможность нахождения в двух изомерных формах – открытой и циклической. Поскольку реакции образования полуацеталей (как и большинство реакций карбонильных соединений) микроскопически обратимы (стр. 234), в растворах происходит как прямая реакция циклополуацетализации, так и обратная реакция распада полуацеталя с регенерацией открытой формы; это приводит к установлению равновесия. Таким образом, моносахариды в растворе представляют собой равновесные смеси открытых и циклических форм; как известно, легкий взаимный переход изомеров с миграцией каких-либо групп (а здесь мигрирует протон) относится к динамической изомерии или таутомерии (см. стр. 193); следовательно, в растворах моносахаридов имеет место кольчато-цепная таутомерия. Таутомерные превращения в этих системах происходят достаточно медленно. Равновесие в растворах обычно в очень значительной степени сдвинуто в сторону циклических форм. При кристаллизации из раствора обычно получается одна форма – как правило, циклическая.
Стереоизомерия циклических форм моносахаридов.
Появление циклических форм моносахаридов вносит новые элементы в их стереохимию; это касается как конфигураций, так и конформаций данных соединений.
А. Конфигурации. В циклической форме появляется дополнительный асимметрический атом углерода: атом С1 для альдоз и атом С2 для кетоз. Этот новый асимметрический атом называют аномерным атомом углерода или аномерным центром. Поэтому из одного изомера открытой формы могут образоваться две диастереомерные циклические формы, которые отличаются конфигурацией при аномерном центре. Эти стереоизомерные формы называют иформами, а также аномерами (аномерными формами).
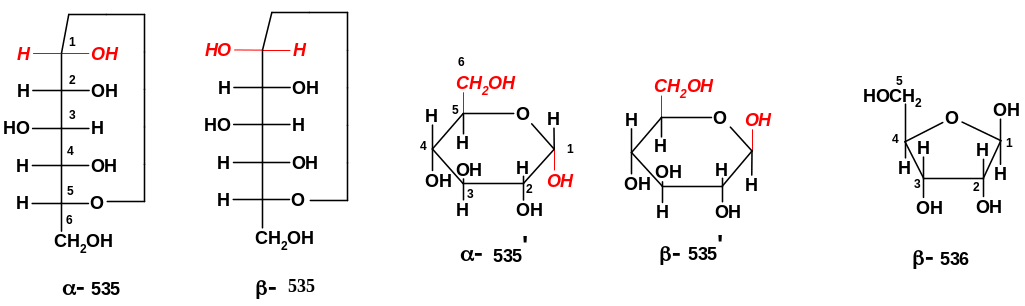 Для
изображения конфигураций циклических
форм можно использовать проекции Фишера,
однако они не очень наглядно отражают
циклическую структуру и вынужденно
содержат “длинные” и “изогнутые”
связи. Значительно удобнее использовать
структуры
Хеуорса, представляющие
собой плоские многоугольники. В качестве
иллюстрации можно представить аномерные
пиранозные формы наиболее распространенного
моносахарида – D-глюкозы
(535) и фуранозную форму одного из аномеров
альдопентозы – D-рибозы
(536):
Для
изображения конфигураций циклических
форм можно использовать проекции Фишера,
однако они не очень наглядно отражают
циклическую структуру и вынужденно
содержат “длинные” и “изогнутые”
связи. Значительно удобнее использовать
структуры
Хеуорса, представляющие
собой плоские многоугольники. В качестве
иллюстрации можно представить аномерные
пиранозные формы наиболее распространенного
моносахарида – D-глюкозы
(535) и фуранозную форму одного из аномеров
альдопентозы – D-рибозы
(536):
Для перехода от проекций Фишера [например, (535)] к структурам Хеуорса [например, (535’)] можно руководствоваться простым правилом: все заместители ОН или Н, стоящие справа в проекции Фишера, располагаются в структуре Хеуорса снизу от цикла, а стоящие слева – сверху. Группа СН2ОН (если она есть) для моносахаридов D-ряда располагается сверху от цикла.
Рассматривая проекции Фишера, нетрудно заметить, что -аномер [например, (-535)] имеет одинаковые конфигурации при аномерном атоме (в нашем случае при С1) и «ключевом» асимметрическом атоме, определяющем принадлежность к данному стереохимическому ряду (в нашем случае при С5); у -аномера конфигурации при этих атомах противоположны. В структурах Хеуорса для соединений D-ряда у -аномеров группа ОН при новом асимметрическом атоме [ в нашем случае при С1 для (-535’)] направлена вниз от цикла, а у -аномеров – вверх. Нетрудно также заметить, что в структурах Хеуорса для -аномеров группа ОН при С1 и группа СН2ОН находятся в транс-положении, а для -аномеров – в цис-положении; таким образом, представленная на рисунке структура D-рибозы (536) относится к -аномеру (именно в такой конфигурации она входит в структуру РНК). Указанные признаки позволяют без труда определить по структурной формуле «аномерную принадлежность» той или иной структуры моносахарида.
Циклическая структура моносахаридов учитывается в их номенклатуре. Названия циклических форм складываются из названий их открытых форм и названия типа циклической структуры с указанием вида аномера. Например, структура (-535’) имеет название -D-глюкопираноза, а структура (-536) - -D-рибофураноза.
О терминах «аномер» и «эпимер». Неоднократно упоминавшиеся выше аномеры – частный случай эпимеров. Эпимерами называют диастереомеры соединений с несколькими асимметрическими атомами углерода, отличающиеся конфигурацией только при одном асимметрическом атоме (хиральном центре); конфигурации при всех остальных асимметрических атомах у эпимеров совпадают. Этот термин используется не только для углеводов, но вообще для любых соединений с несколькими хиральными центрами. Аномеры - это эпимеры циклических форм моносахаридов, которые отличаются конфигурацией именно при аномерном центре, т.е. хиральном центре, возникающем при образовании циклической формы. То, что термин «эпимер» применяется более широко, чем «аномер», можно проиллюстрировать на примере моносахаридов. Эпимеры могут иметь как открытую, так и циклическую форму. Например, в открытых формах (см. стр. 279) D-рибоза и D-арабиноза являются эпимерами по С2, точно так же эпимерны по С2 D-глюкоза и D-манноза; D-аллоза и D-глюкоза эпимерны по С3. В циклических формах эти же пары будут эпимерны (но не аномерны!), только если они находятся в одинаковых аномерных формах; например, -D-глюкопираноза и -D-маннопираноза эпимерны по С2. В то же время, -D-глюкопираноза и D-маннопираноза уже не являются эпимерами, потому что у них различны конфигурации при двух хиральных центрах – при С1 и при С2.
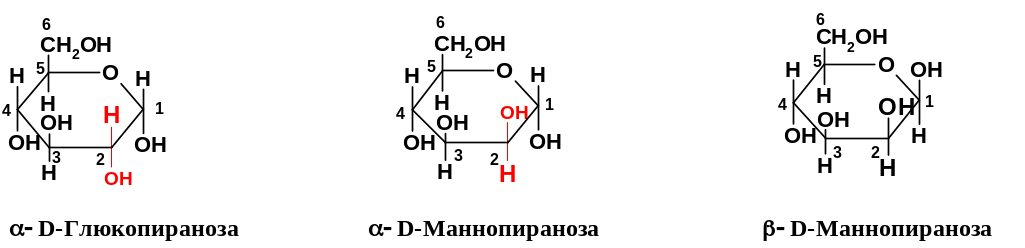 Пиранозные
и фуранозные формы – что предпочтительней?
В общем случае, пиранозные формы несколько
более устойчивы, чем фуранозные, и потому
встречаются несколько чаще. Для
альдогексоз
пиранозная форма безусловно предпочтительна;
для некоторых альдопентоз
фуранозные формы присутствуют в заметных
количествах, хотя обычно в меньших, чем
пиранозные. Например, D-рибоза
в водном растворе содержит 56% -пиранозида,
20% -пиранозида,
18% -фуранозида
и 6% -фуранозида
(тем не менее, D-рибоза
входит в состав РНК в фуранозной
форме). Другая альдопентоза - ксилоза
- существует почти исключительно в
пиранозных формах. Сходная ситуация
наблюдается для кетогексоз;
здесь также присутствуют и пиранозные
и фуранозные формы. Соотношение как
пиранозных и фуранозных форм, так и
аномеров зависит от условий, прежде
всего от растворителей.
Пиранозные
и фуранозные формы – что предпочтительней?
В общем случае, пиранозные формы несколько
более устойчивы, чем фуранозные, и потому
встречаются несколько чаще. Для
альдогексоз
пиранозная форма безусловно предпочтительна;
для некоторых альдопентоз
фуранозные формы присутствуют в заметных
количествах, хотя обычно в меньших, чем
пиранозные. Например, D-рибоза
в водном растворе содержит 56% -пиранозида,
20% -пиранозида,
18% -фуранозида
и 6% -фуранозида
(тем не менее, D-рибоза
входит в состав РНК в фуранозной
форме). Другая альдопентоза - ксилоза
- существует почти исключительно в
пиранозных формах. Сходная ситуация
наблюдается для кетогексоз;
здесь также присутствуют и пиранозные
и фуранозные формы. Соотношение как
пиранозных и фуранозных форм, так и
аномеров зависит от условий, прежде
всего от растворителей.
Мутаротация как индикатор кольчато-цепной таутомерии. Как уже упоминалось, при кристаллизации из растворов получаются индивидуальные моносахариды в циклической форме; в зависимости от условий кристаллизации можно получить тот или иной аномер: например, D-глюкоза при кристаллизации из воды выделяется в виде -пиранозы, а при кристаллизации из пиридина – в виде -пиранозы.
Поскольку все индивидуальные моносахариды, как и многие другие индивидуальные природные соединения, представляют собой чистые энантиомеры (а не рацематы, как очень многие синтетические соединения), они являются оптически активными, т.е. вращают плоскость поляризации поляризованного света. Разные аномеры, являясь диастереомерами, показывают разные величины углов вращения; в частности, -D-глюкопираноза показывает значение [D = +1120, а -D-глюкопираноза - +190. {Индексом [D принято обозначать угол вращения плоскости поляризации поляризованного света с длиной волны желтой линии натрия (D, =589 нм); этот индекс не следует путать с обозначением -аномеров}.
При растворении кристаллического индивидуального аномера в образующемся растворе «включается» кольчато-цепная таутомерия, и устанавливается равновесие между двумя аномерами с промежуточным образованием открытой формы (которая обычно присутствует в равновесной смеси в малых количествах); ниже это показано на примере D-глюкозы:
Р авновесие
устанавливается
постепенно,
т.к. таутомерные превращения протекают
медленно При этом угол вращения, который
в
первый момент после растворения
соответствует индивидуальному аномеру,
постепенно меняется и, в конечном счете,
устанавливается на значении, соответствующем
углу вращения равновесной смеси.
Например, при растворении как ,
так и -аномеров
D-глюкозы
в воде в конечном счете получается
раствор с [D=
+530,
что соответствует равновесной смеси,
содержащей 64% -формы
и 36% -формы
(открытая форма присутствует в смеси в
количестве 0,02%). В ряде других случаев,
например, для D-рибозы,
изменение угла вращения связано с
образованием большего количества форм,
находящихся в равновесии ( т.е. и пиранозных
и фуранозных).
авновесие
устанавливается
постепенно,
т.к. таутомерные превращения протекают
медленно При этом угол вращения, который
в
первый момент после растворения
соответствует индивидуальному аномеру,
постепенно меняется и, в конечном счете,
устанавливается на значении, соответствующем
углу вращения равновесной смеси.
Например, при растворении как ,
так и -аномеров
D-глюкозы
в воде в конечном счете получается
раствор с [D=
+530,
что соответствует равновесной смеси,
содержащей 64% -формы
и 36% -формы
(открытая форма присутствует в смеси в
количестве 0,02%). В ряде других случаев,
например, для D-рибозы,
изменение угла вращения связано с
образованием большего количества форм,
находящихся в равновесии ( т.е. и пиранозных
и фуранозных).
Такое изменение угла вращения носит название мутаротации; она является следствием кольчато-цепной таутомерии и связанной с ней аномеризации (взаимного перехода между аномерами). Наличие мутаротации указывает на существование кольчато-цепной таутомерии и в ряде случаев позволяет определить соотношение аномеров в равновесной смеси.
Б. Конформации. Структуры Хеуорса изображают 5- и 6-членные циклы плоскими, каковыми они в действительности не являются.
5-членный цикл в фуранозных формах может, в частности, находиться в форме конверта (один атом выходит из плоскости, см. стр. 69). Для пиранозных форм всех моносахаридов наиболее устойчивы формы кресла, причем такие конформации кресла, в которых большинство заместителей (кроме заместителей у аномерного атома углерода) находятся в экваториальном положении. Наиболее устойчивой пиранозной формой является D-глюкопираноза – это единственный полисахарид, у которого все заместители при С2-С5 экваториальны:
В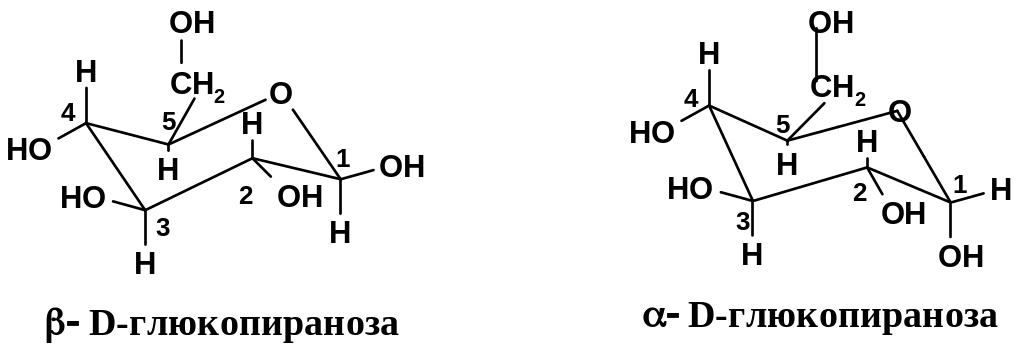 ероятно,
именно вследствие наибольшей устойчивости
глюкоза является самым распространенным
моносахаридом.
ероятно,
именно вследствие наибольшей устойчивости
глюкоза является самым распространенным
моносахаридом.
Что касается положения заместителя при аномерном атоме (в данном случае при С1), то здесь дело обстоит сложнее. У самих моносахаридов экваториальное положение также энергетически несколько предпочтительнее аксиального, хотя и не в такой степени, как для остальных положений; поэтому, например, в равновесной смеси аномеров глюкозы содержится несколько больше аномера. Однако у многих производных моносахаридов, таких, как гликозиды, более выгодным становится аксиальное положение. Это – так называемый аномерный эффект, который будет рассмотрен несколько позже.
