
- •Глава VIII. Углеводы
- •VIII.1. Моносахариды
- •VIII.1.1. Стереоизомерия открытых форм моносахаридов; d- и l-ряды.
- •VIII.1.2. Кольчато-цепная таутомерия моносахаридов.
- •VIII.1.3. Химические свойства моносахаридов
- •VIII.1. 3.1. Реакции гидроксигрупп моносахаридов
- •1. Образование ацеталей (гликозидов).
- •2 . Образование аминоацеталей (n-гликозидов).
- •1. Синтез простых эфиров(алкилирование).
- •3. Образование сложных эфиров.
- •VIII.1.3.2. Реакции карбонильной группы.
- •1.Взаимодействие с фенилгидразином. Озазоны.
- •3. Взаимодействие с другими нуклеофилами.
- •VII.1.3.3. Реакции окисления и восстановления
- •Получение альдоновых кислот.
- •2. Получение гликаровых (сахарных) кислот.
- •3. Образование гликуроновых кислот.
- •4 . Деструктивное окисление.
- •VIII.1.3.4. Некоторые превращения в ряду моносахаридов.
- •Получение высших полисахаридов из низших
- •VIII.1.4. Некоторые моносахариды с модифицированной структурой
- •VIII.2. Олигосахариды
- •VIII.2.1. Дисахариды
- •VIII.2.2. Высшие олигосахариды
- •VIII.3. Полисахариды
VIII.2.2. Высшие олигосахариды
Трисахарид раффиноза и тетрасахарид стахиоза встречаются в растениях почти столь же широко, как и сахароза. Раффиноза имеет структуру D-Gal-(16)--D-Glc-(12)--D-Fruf, а стахиоза - -D-Gal-(16)--D-Gal-(16)--D-Glc-(12)--D-Fruf. Оба олигосахарида являются невосстанавливающими; нетрудно заметить их родство с сахарозой.
 Ряд олигосахаридов
(как дисахаридов, так и высших) встречается
в природе в виде гликозидов с различными
агликонами; например, с агликонами
стероидного характера; их можно
представить обобщенной формулой (573):
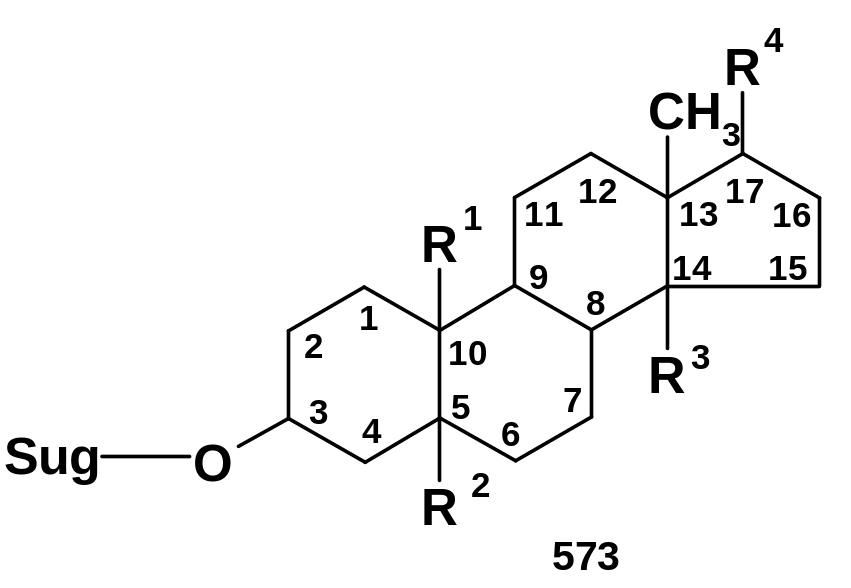
Ряд олигосахаридов
(как дисахаридов, так и высших) встречается
в природе в виде гликозидов с различными
агликонами; например, с агликонами
стероидного характера; их можно
представить обобщенной формулой (573):
Sug (сахар) – моносахарид или олигосахарид, связанный с положением 3 стероидной системы гликозидной связью; в положении 4(5) агликона часто находится двойная связь. Олигосахаридные цепи могут иметь как линейную, так и разветвленную структуру.
К стероидным гликозидам, в частности, относятся сердечные гликозиды (строфантин, уабаин и другие). Родственное строение имеют гликозиды, обуславливающие биологическую активность женьшеня, и ряд других гликозидов растительного и животного происхождения. Весьма важные биологические функции выполняют гликопротеины, в которых олигосахаридные цепи связаны О- или N-гликозидной связью с белками (полипептидными цепями); к ним относятся иммуноглобулины и групповые вещества крови. Олигосахаридные цепи этих соединений содержат 10 и более остатков моносахаридов.
Синтез олигосахаридов.
 Олигосахариды
синтезируют из соответствующих
моносахаридов. Поскольку олигосахариды
построены по типу гликозидов, их синтез
– частный случай синтеза гликозидов.
В качестве гликозилирующих реагентов
используют некоторые производные
моносахаридов; в частности,
ацилгликозилгалогениды
(стр. 290). Одна из основных проблем –
обеспечить образование гликозида по
определенному положению
следующего моносахарида. Для решения
этой проблемы все группы ОН этого
моносахарида, которые не должны вступать
в реакцию, защищают
(временно модифицируют, лишая их
возможности вступать в соответствующую
реакцию), оставляя нетронутой лишь
«нужную» группу. В качестве простого
примера можно привести синтез дисахарида
гентиобиозы по старинному, но до сих
пор иногда применяемому методу
Кёнигса-Кнорра:
Олигосахариды
синтезируют из соответствующих
моносахаридов. Поскольку олигосахариды
построены по типу гликозидов, их синтез
– частный случай синтеза гликозидов.
В качестве гликозилирующих реагентов
используют некоторые производные
моносахаридов; в частности,
ацилгликозилгалогениды
(стр. 290). Одна из основных проблем –
обеспечить образование гликозида по
определенному положению
следующего моносахарида. Для решения
этой проблемы все группы ОН этого
моносахарида, которые не должны вступать
в реакцию, защищают
(временно модифицируют, лишая их
возможности вступать в соответствующую
реакцию), оставляя нетронутой лишь
«нужную» группу. В качестве простого
примера можно привести синтез дисахарида
гентиобиозы по старинному, но до сих
пор иногда применяемому методу
Кёнигса-Кнорра:
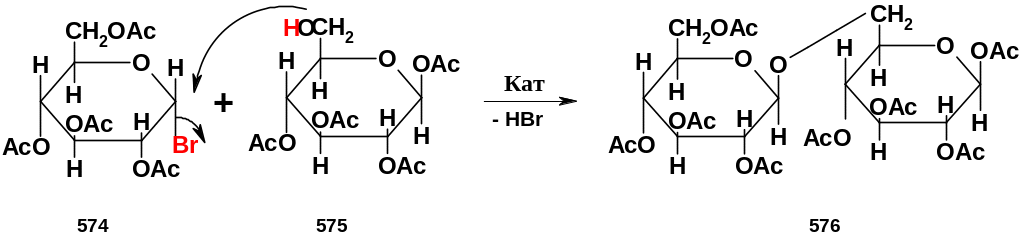
Здесь взаимодействуют 2,3,4,6-тетраацетилглюкозилбромид (574) и 1,2,3,4-тетраацетилглюкоза (575), в которой незащищенной остается группа ОН при С6; в качестве катализаторов используют Ag2CO3 или Hg(CN)2; образуется (16)-гликозидная связь, причем достаточно стереоселективно – преимущественно -конфигурации (происходит обращение конфигурации исходного гликозилгалогенида). Продукт реакции – октаацетат гентиобиозы (576) – может быть превращен в саму гентиобиозу после снятия ацетильной защиты.
Подобная стратегия – защита «лишних» функциональных групп – исключительно широко используется в органическом синтезе; в частности, она является ключевой в синтезах in vitro таких важнейших природных соединений, как пептиды и белки, олигонуклеотиды и нуклеиновые кислоты. Набор приемов защиты и ассортимент защитных групп исключительно велики. [Кстати, соединение (575) получить не так уж сложно – для этого нужно вначале получить тритильный эфир по С6 (стр. 288), далее проацетилировать все остальные группы ОН, а затем аккуратно снять тритильную защиту с группы ОН при С6, не затронув ацетильную защиту (такие условия известны, например, действие CF3COOH)].
В настоящее время разработаны более совершенные, нежели метод Кёнигса-Кнорра, способы синтеза олигосахаридов (например, использование ортоэфиров). Эти способы рассматриваются в специальных курсах.
