
- •Глава VII. Карбонильные соединения (альдегиды и кетоны)
- •VII.1. Способы получения
- •А. Пинаколиновая перегруппировка – превращение 1,2-диолов в кетоны.
- •Физические свойства
- •Химические свойства
- •VII.2. Монокарбонильные соединения.
- •VII.2.2. Реакции при атоме углерода, соседнем с карбонильной группой
- •VII.2.3. Реакции окисления и восстановления карбонильных соединений
- •VII.3. Дикарбонильные соединения.
VII.2.2. Реакции при атоме углерода, соседнем с карбонильной группой
Некоторые реакции, затрагивающие -положение к карбонильной группе, уже рассматривались выше (реакции альдольно-кротоновой конденсации, реакция Манниха и др.); соединения, реагирующие по этому положению, в данных случаях рассматривались как нуклеофильные реагенты в реакциях нуклеофильного присоединения по карбонильной группе их реакционных партнеров. Ниже будут рассмотрены реакции по -положению, за которыми не следует присоединения продукта по карбонильной группе другой молекулы.
Все эти реакции, как и уже рассмотренные, используют повышенную СН-кислотность связей С-Н в положении и способность к енолизации; поэтому и здесь соединения, реагирующие по в положению, являются нуклеофилами.
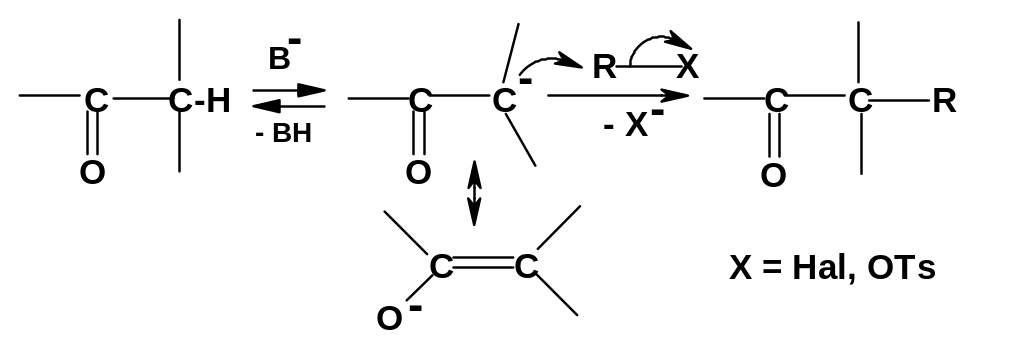 1.
Алкилирование.
Амбидентные енолят-анионы, образующиеся
при депротонировании -положения
под действием оснований, могут не только
присоединяться по карбонильной группе,
но и быть нуклеофильными реагентами в
реакциях нуклеофильного замещения с
галогенпроизводными и тозилатами:
1.
Алкилирование.
Амбидентные енолят-анионы, образующиеся
при депротонировании -положения
под действием оснований, могут не только
присоединяться по карбонильной группе,
но и быть нуклеофильными реагентами в
реакциях нуклеофильного замещения с
галогенпроизводными и тозилатами:
Формальный итог реакции – замещение -атома водорода на алкильную группу R, т.е. -алкилирование карбонильного соединения. Реакции обычно идут по механизму SN2, и амбидентный анион реагирует мягким, т.е. углеродным нуклеофильным центром. Для достижения значительной концентрации енолят-аниона необходимо использовать сильные основания (NH2¯, трет-С4Н9О¯). Проведение алкилирования сталкивается с рядом трудностей: во-первых, с реакцией замещения конкурирует реакция альдольной конденсации; во-вторых, трудно остановить реакцию на стадии моноалкилирования – имеется тенденция к замещению всех (двух или трех) -водородных атомов.
Гораздо проще идет алкилирование 1,3-дикарбонильных соединений; это будет рассмотрено ниже. Для алкилирования же монокарбонильных соединений удобнее проводить не прямую реакцию, а использовать обходной путь – через енамины. Как было показано (стр. 241) , енамины легко образуются при взаимодействии карбонильных соединений и вторичных аминов; там же было упомянуто о широком использовании енаминов в органическом синтезе. Одним из важных аспектов такого использования и является алкилирование енаминов. Енамины – достаточно сильные С-нуклеофилы за счет электронодонорного влияния атома азота:

Их нуклеофильности вполне достаточно для реакции с галогенпроизводными или тозилатами по механизму SN2:
 Продукт
реакции алкилирования енамина –
иминиевая соль (466) – легко может быть
гидролизована в кислой среде с образованием
-моноалкилированного
кетона. Этот путь моноалкилирования
кетонов хотя и длиннее, чем прямая
реакция, но избавлен от упомянутых выше
сложностей; поэтому алкилирование
енаминов используется достаточно
широко.
Продукт
реакции алкилирования енамина –
иминиевая соль (466) – легко может быть
гидролизована в кислой среде с образованием
-моноалкилированного
кетона. Этот путь моноалкилирования
кетонов хотя и длиннее, чем прямая
реакция, но избавлен от упомянутых выше
сложностей; поэтому алкилирование
енаминов используется достаточно
широко.
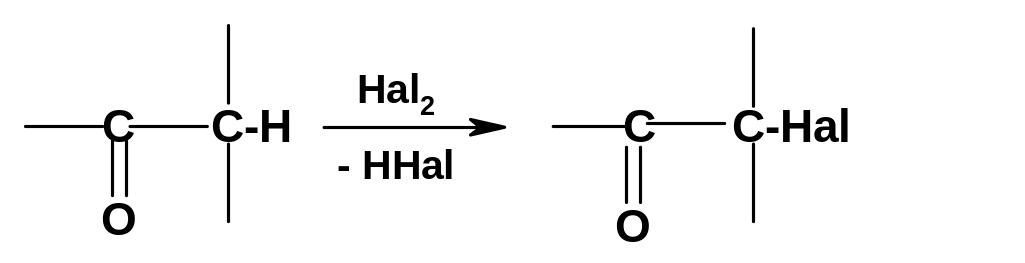 2.
Галогенирование.
Атомы водорода в -положениях
карбонильных соединений легко замещаются
на галоген при взаимодействии с хлором
и бромом, а иногда и иодом:
2.
Галогенирование.
Атомы водорода в -положениях
карбонильных соединений легко замещаются
на галоген при взаимодействии с хлором
и бромом, а иногда и иодом:
В отличие от замещения водорода на галоген в алканах, аллильном и бензильном положениях, -галогенирование карбонильных соединений идет не по радикальному, а по ионному механизму. Суть реакции – электрофильное присоединение галогена к связи С=С енольной формы карбонильного соединения:
П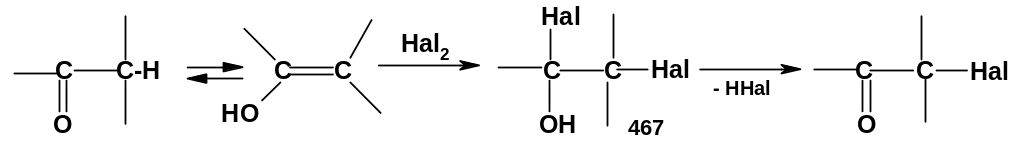 рисоединение
идет легко, т.к. связь С=С енольной формы
имеет повышенную нуклеофильность (см.
выше). Образующийся при этом
гидроксидигалогенид (467) неустойчив,
т.к. содержит два электроотрицательных
атома (ОН и На1) при одном атоме углерода;
он отщепляет ННа1, что и приводит к
-галогенкетону.
Таким образом, галогенирование идет по
схеме «присоединение-отщепление».
Естественно, что реакция галогенирования
ускоряется при добавлении кислот и
оснований, т.к. они способствуют
енолизации. Обычно используют основный
катализ.
рисоединение
идет легко, т.к. связь С=С енольной формы
имеет повышенную нуклеофильность (см.
выше). Образующийся при этом
гидроксидигалогенид (467) неустойчив,
т.к. содержит два электроотрицательных
атома (ОН и На1) при одном атоме углерода;
он отщепляет ННа1, что и приводит к
-галогенкетону.
Таким образом, галогенирование идет по
схеме «присоединение-отщепление».
Естественно, что реакция галогенирования
ускоряется при добавлении кислот и
оснований, т.к. они способствуют
енолизации. Обычно используют основный
катализ.
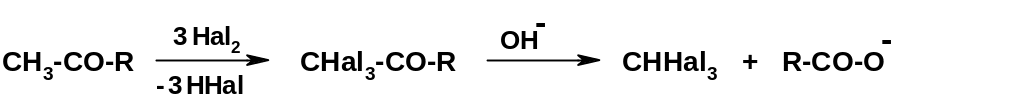 Особый
случай – взаимодействие метилкетонов
СН3-СO-R
с избытком галогенов в
присутствии щелочи: при этом замещаются
на галоген все три атома водорода
метильной группы; полученное производное
распадается под действием щелочи с
образованием галоформа:
Особый
случай – взаимодействие метилкетонов
СН3-СO-R
с избытком галогенов в
присутствии щелочи: при этом замещаются
на галоген все три атома водорода
метильной группы; полученное производное
распадается под действием щелочи с
образованием галоформа:
Эта реакция носит название галоформной. Если в качестве галогена использовать иод, то образуется иодоформ СHJ3 – кристаллы желтого цвета, которые легко идентифицировать; поэтому «иодоформная проба» используется для обнаружения метилкетонов.
3. Нитрозирование. Эта реакция протекает при действии эфиров азотистой кислоты (алкилнитритов) в кислой среде на карбонильные соединения, имеющие -СН2-группу:
П родукты
реакции - -нитрозокетоны
(468) – таутомеризуются в оксимы 1,2-дикарбо-
нильных соединений (469). Внешне таутомерия
нитрозосоединение – оксим напоминает
кето-енольную (стр. 233); равновесие,
однако, практически нацело сдвинуто в
сторону аналога енольной формы - оксима
(469). Оксимы (469) можно превратить в
соответствующие 1,2-дикарбонильные
соединения путем гидролиза, а можно
использовать для других превращений,
в частности, для синтеза комплексонов
и гетероциклических соединений.
родукты
реакции - -нитрозокетоны
(468) – таутомеризуются в оксимы 1,2-дикарбо-
нильных соединений (469). Внешне таутомерия
нитрозосоединение – оксим напоминает
кето-енольную (стр. 233); равновесие,
однако, практически нацело сдвинуто в
сторону аналога енольной формы - оксима
(469). Оксимы (469) можно превратить в
соответствующие 1,2-дикарбонильные
соединения путем гидролиза, а можно
использовать для других превращений,
в частности, для синтеза комплексонов
и гетероциклических соединений.
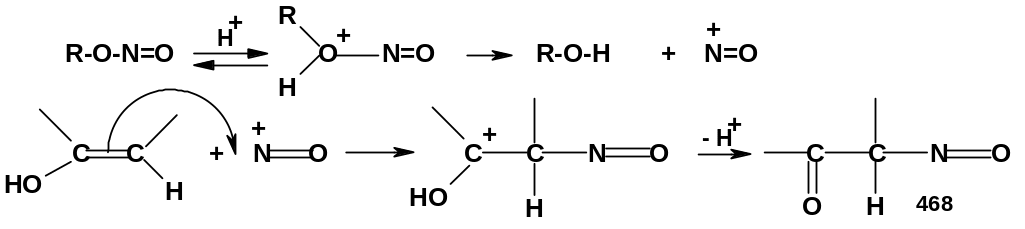 Подобно
галогенированию, нитрозирование
протекает как электрофильное присоединение
к связи С=С енольной формы карбонильного
соединения:
Подобно
галогенированию, нитрозирование
протекает как электрофильное присоединение
к связи С=С енольной формы карбонильного
соединения:
Электрофильной частицей является нитрозоний-катион +N=O, который образуется из нитрита после протонирования и отрыва молекулы спирта.
