
- •I.6.2.2.Реакции присоединения к ароматическому ядру.
- •I.6.2.3. Реакции боковых цепей, связанных с ароматическими ядрами.
- •I.6.2.4. Реакции окисления и восстановления.
- •Глава II. Галогенпроизводные углеводородов
- •II.1. Способы получения галогенопроизводных.
- •Физические свойства
- •Химические свойства
- •II.2. Химические свойства галогенпроизводных со связью с(sp3)-Hal
- •II.2.1. Реакции нуклеофильного замещения
- •1. Мономолекулярное нуклеофильное замещение
- •2. Бимолекулярное нуклеофильное замещение
- •II.2.2. Реакции -элиминирования (дегидрогалогенирования)
- •II.2.3. Реакции -элиминирования (образование карбенов).
- •II.3. Химические свойства галогенпроизводных со связью с(sр2)-Hal
- •II.3.1. Галогеналкены
- •II.3.2. Галогенарены
- •II.4. Практическое использование галогенпроизводных
Глава II. Галогенпроизводные углеводородов
Известны как моно-, так и полигалогенпроизводные всех типов углеводородов – от алканов до аренов; известны фтор-, хлор-, бром- и иодпроизводные.
II.1. Способы получения галогенопроизводных.
1. Замещение атомов водорода в углеводородах. Эти способы уже рассматривались: галогенирование алканов, аллильного положения в алкенах, бензильного положения в аренах, галогенирование аренов в ядро.
2. Присоединение галогенов и галогеноводородов к ненасыщенным соединениям. Эти реакции также рассматривались: присоединение Hal2 и ННal к алкенам и алкинам, присоединение хлора к аренам.
3. Получение из спиртов путем замены гидроксигруппы на галоген:
R-OH → R-X (X=Cl, Br, J).
В качестве реагентов для проведения этой реакции можно использовать галогеноводороды НHal, галогениды фосфора РHal3 и PHal5, тионилхлорид SOCl2. Более подробно эти реакции будут рассмотрены в разделе «спирты».
Физические свойства
Фторметан, хлорметан и еще несколько простейших галогеналканов при обычных условиях являются газообразными, большинство других моногалогенпроизводных являются жидкостями, обычно тяжелее воды; многие полигалогенпроизводные являются кристаллическими веществами. Температуры кипения возрастают от фторпроизводных к иодпроизводным.
Для обнаружения галогена в органических молекулах можно использовать весьма простую качественную «пробу Бейльштейна»: на нагретую медную проволоку помещают крупинку вещества и проволоку вносят в пламя горелки: если в состав вещества входит галоген, образуется летучий галогенид меди, и пламя окрашивается в зеленый цвет за счет катиона меди.
Химические свойства
Целесообразно отдельно рассмотреть химические свойства двух групп галогенпроизводных: I. Cоединений со связью С(sp3) – Hal; II. Соединений со связью С(sp2)-Hal; свойства этих групп соединений значительно различаются.
II.2. Химические свойства галогенпроизводных со связью с(sp3)-Hal
Связь С(sp3)→Hal достаточно сильно поляризована таким образом, что электронная плотность смещена к атому галогена, более электроотрицательному, чем атом углерода; на атоме углерода возникает частичный положительный заряд, а на атоме галогена – частичный отрицательный заряд. Следовательно, данная связь имеет тенденцию к гетеролитическому разрыву так, что атом галогена уходит в виде аниона. Этот разрыв лежит в основе двух наиболее важных типов реакций галогенопроизводных – реакций нуклеофильного замещения и реакций элиминирования (отщепления) – в данном случае отщепления галогенводорода. Оба типа реакций протекают при действии сходных реагентов: нуклеофильное замещение – при действии нуклеофилов (нуклеофильных реагентов), элиминирование – при действии оснований Бренстеда. Поскольку нуклеофилы одновременно являются и основаниями Бренстеда, при действии на галогенпроизводное одного и того же реагента возможна конкуренция между нуклеофильным замещением и элиминированием.
II.2.1. Реакции нуклеофильного замещения
 Данный
тип реакции обозначается индексом SN
(от англ. Substitution
nucleophilic).
Общую схему реакций нуклеофильного
замещения при sp3-атоме
углерода
можно представить следующим образом:
Данный
тип реакции обозначается индексом SN
(от англ. Substitution
nucleophilic).
Общую схему реакций нуклеофильного
замещения при sp3-атоме
углерода
можно представить следующим образом:
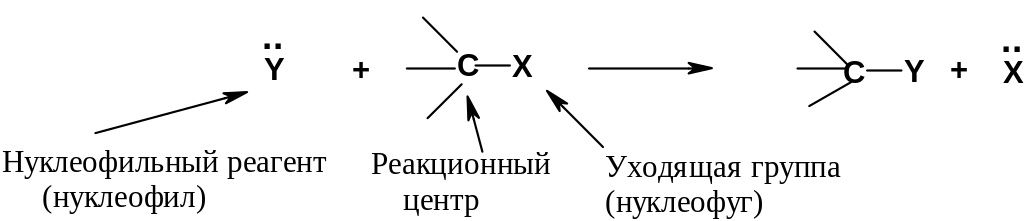
Частица Y – нуклеофильный реагент или просто нуклеофил – донор электронной пары. Наиболее типичные нуклеофилы: 1. Анионы; 2. Нейтральные молекулы, содержащие атомы с неподеленными парами электронов.
Соединение, в котором происходит замещение, – субстрат; он проявляет электрофильные свойства за счет частичного положительного заряда на атоме углерода.
Атом углерода в субстрате, при котором происходит замещение, называется реакционным центром.
Замещаемая группа Х в субстрате называется уходящей группой или нуклеофугом. Нуклеофуг может быть нейтральным или нести положительный заряд; нейтральный нуклеофуг отщепляется в виде аниона, положительно заряженный – в виде нейтральной частицы.
Наиболее типичные субстраты в реакциях нуклеофильного замещения при sp3-атоме углерода – галогенпроизводные, спирты и производные спиртов.
 Для
галогенпроизводных (Х=Hal)
нуклеофуг является нейтральным и
отщепляется в виде аниона:
Для
галогенпроизводных (Х=Hal)
нуклеофуг является нейтральным и
отщепляется в виде аниона:
Реакции нуклеофильного замещения атомов галогена открывают огромные возможности как для введения в молекулу различных функциональных групп (функционализации), так и для наращивания и модификации углеродного скелета. Последний аспект будет подробнее раскрыт позднее (при рассмотрении 1,3-дикетонов, малонового и ацетоуксусного эфиров); здесь будут рассмотрены по большей части реакции функционализации.
 Некоторые
важнейшие реакции нуклеофильного
замещения галогена при насыщенном
углеродном атоме представлены на
приведенной ниже схеме:
Некоторые
важнейшие реакции нуклеофильного
замещения галогена при насыщенном
углеродном атоме представлены на
приведенной ниже схеме:
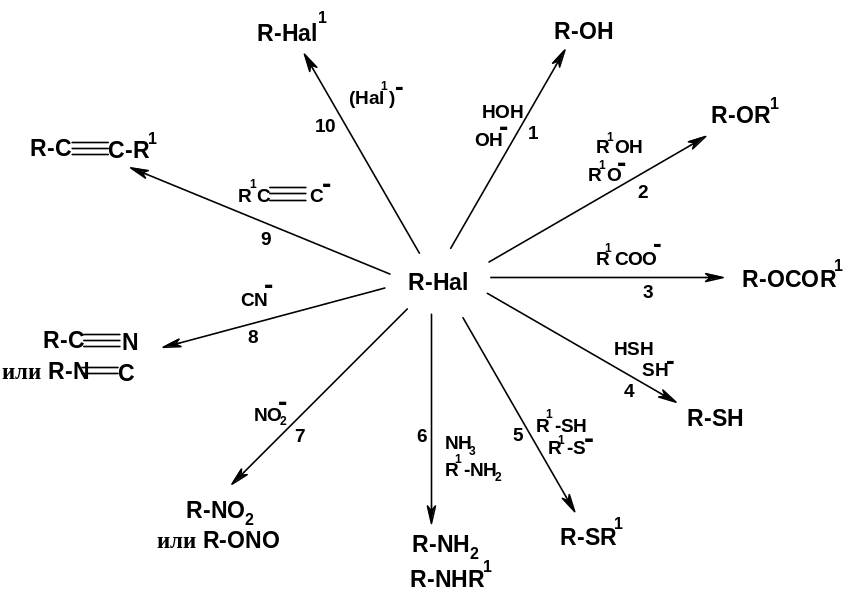
Здесь приведены общие схемы реакций:
А. С О-нуклеофилами с образованием спиртов (реакция 1), простых эфиров (реакция 2), сложных эфиров (реакция 3);
Б. С S-нуклеофилами с образованием тиоспиртов (тиолов) (реакция 4) или тиоаналогов простых эфиров – диалкилсульфидов (реакция 5);
В. С N-нуклеофилами с образованием аминов (реакция 6), нитросоединений или эфиров азотистой кислоты (алкилнитритов) (реакция 7);
Г. С С-нуклеофилами с образованием нитрилов или изонитрилов (реакция 8), гомологов ацетилена (реакция 9); реакция с этим типом нуклеофилов приводит к наращиванию углеродного скелета на один атом углерода (реакция 8) или к «сшиванию» двух углеродных фрагментов любой величины (реакция 9)
Д. С галогенид-анионами, результатом чего является обмен одного галогена на другой (реакция 10).
Таким образом, из этой, далеко не полной схемы, ясно, насколько широк круг веществ, которые могут быть получены, исходя из галогенпроизводных.
Далее будут рассмотрены механизмы реакций нуклеофильного замещения при sp3-атоме углерода. Механизмы этих реакций наряду с механизмами электрофильного ароматического замещения относятся к наиболее изученным типам механизмов; именно на примере этих реакций формировались представления о механизмах реакций на начальных этапах их изучения (К.Ингольд и его школа, 30-е годы ХХ-го века); современные исследования также во многом базируются на реакциях нуклеофильного замещения. Найденные закономерности позволяют управлять протеканием этих реакций, оптимизировать условия их проведения.
Если рассматривать реакцию замещения (любого - нуклеофильного, электрофильного, радикального) в общем, то чисто формально можно представить три основных последовательности операций при ее протекании:
1. Вначале уходит замещаемая группа, а затем вступает замещающая (вначале разрывается связь с замещаемой группой, затем образуется связь с замещающей).
2. Уход замещаемой группы и вступление замещающей группы происходят синхронно (разрыв одной связи и образование другой происходят одновременно).
3. Вначале присоединяется замещающая группа, а затем уходит замещаемая (вначале образуется одна связь, затем разрывается другая).
Если вспомнить уже рассмотренные ранее реакции замещения, то нетрудно убедиться, что радикальное замещение в алканах (а также в аллильном и бензильном положениях) протекает по схеме 1, а электрофильное замещение в ароматическом ядре - по схеме 3.
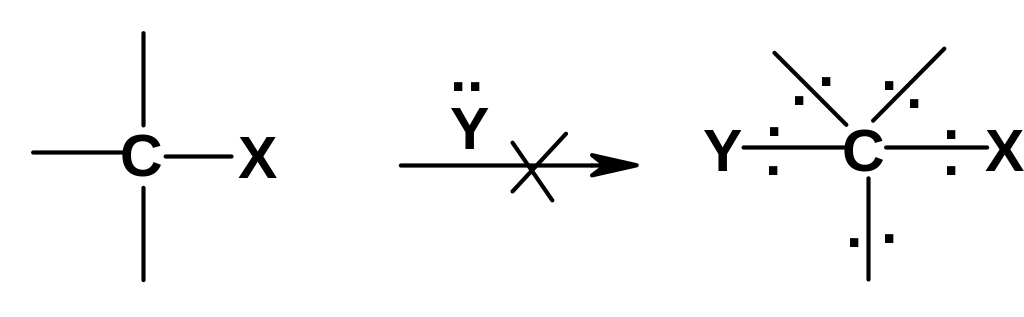 Что касается
нуклеофильного замещения при
sp3-атоме
углерода,
то оно может протекать по схемам 1 и 2;
схема 3 невозможна, так как после
присоединения замещающей группы должен
образоваться интермедиат с 10 электронами
вокруг атома углерода:
Что касается
нуклеофильного замещения при
sp3-атоме
углерода,
то оно может протекать по схемам 1 и 2;
схема 3 невозможна, так как после
присоединения замещающей группы должен
образоваться интермедиат с 10 электронами
вокруг атома углерода:
Каждой из двух формальных схем (1 и 2) соответствует свой механизм протекания реакции; таким образом существуют два типовых механизма реакций нуклеофильного замещения при sp3-атоме углерода. Рассмотрим эти механизмы на примере нуклеофильного замещения атомов галогена.
