
СОДЕРЖАНИЕ
Структура андрогенов
Биосинтез андрогенов
Транспорт андрогенов
Рецепция андрогенов
Действие андрогенов
Метаболизм андрогенов
Заключение
Список использованной литературы
ХИМИЧЕСКАЯ СТРУКТУРА АНДРОГЕНОВ
По химической природе андрогены классифицируются как стероидные гормоны, имеющие в своём составе C19-углеродный скелет. Их также называют андростановыми стероидами. Гормоны класса стероидов представляют собой полициклические соединения липидной природы, в основе которых лежит циклопентанпергидрофенантреновое (стерановое) ядро, состоящее из конденсированных между собой трёх насыщенных шестичленных колец (A, B, C) и одного насыщенного пятичленного (D) кольца.
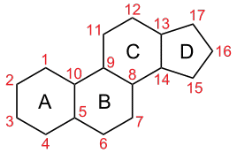
Стерановое ядро обусловливает единство полиморфного по строению и функциям класса стероидных гормонов. Стероидные соединения относительно плохо растворяются в воде и хорошо - в неполярных растворителях: органических растворителях, маслах и белковых растворах. Стероиды характеризуются трёхмерной пространственной конфигурацией, особенности которой существенно влияют на их биологическую активность. Геометрическая форма стероидной молекулы достаточно стабильна и определяется конформацией колец, характером их соединения, а также расположением атомов водорода, радикалов и функциональных групп, присоединённых к стерановому ядру. Стероиды - оптически активные соединения; все природные гормоны являются производными D-ряда. Класс стероидных гормонов включает семейства производных четырёх гипотетических стероидов, содержащих различное число углеродных атомов: прегнана C21, андростана C19, эстрана C18, холестана C27. Андрогены можно рассматирвать как производные андростана.
Андростановые стероидные гормоны - производные гипотетического C19-стероида андростана. Это также кетостероиды, отличающиеся от кортикостероидов и прогестинов наличием в-положении OH-группы. Именно эта доминантная группа дифференциально определяет специфическую гормональную активность данных -кетостероидов в соответствующих реагирующих клетках. Без неё все виды активности андрогенов не проявляются. Производные андростана относятся к группе гормональных стероидов андрогенного ряда.
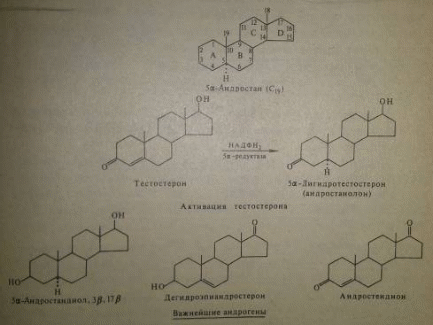
Главный андрогенный (мужской половой) гормон - тестостерон. Его структура была впервые расшифрована Давидом в 1935 году. Андрогенная активность тестостерона определяется наличием 19 углеродных атомов в стерановом скелете, 3-кето-группой в кольце A и, прежде всего, гидроксилом у C17, расположенным в -позиции (17-группа биологически неактивна). Указанные структурные свойства, по-видимому, необходимы для эффективного связывания андрогенов с соответствующими рецепторами. Тестостерон наряду с андрогенными эффектами (стимуляция мужского полового аппарата) способен оказывать на различные ткани (мышцы, почки, печень, матку) мощное анаболическое действие, т.е. увеличивать в них синтез белка.
Андростендион, дегидроэпиандростерон и его сульфат, 11-оксиандростендион, адреностерон гормональной активностью практически не обладают. Однако некоторые соединения могут превращаться в периферических тканях в тестостерон, и наоборот, тестостерон может переходить в андростендион и дегидроэпиандростерон. Также на периферии может происходить и активация тестостерона: под действием фермента 5-редуктазы тестостерон может превращаться в ряде тканей-мишеней в 5-дигидротестостерон (5-андростанолон), обладающий по ряду показателей значительно большей андрогенной активностью, чем тестостерон. Так, 5-дигидротестостерон гораздо сильнее связывается с андрогенными рецепторами тканей, чем исходное соединение (тестостерон). С повышенным образованием дигидротестостерона из тестостерона в ткани простаты связывают гипертрофию и гиперплазию простаты, развитие аденомы простаты и, возможно, повышение вероятности развития рака простаты. С повышенным образованием дигидротестостерона в волосяных фолликулах связывают чрезмерное оволосение тела и/или «мужской» тип облысения на голове у обоих полов. Увеличивается жирность кожи, что ведёт к образованию угрей. С пониженным или нулевым образованием дигидротестостерона из тестостерона связывают одну из форм синдрома тестикулярной феминизации - нечувствительность тканей к тестостерону. Дигидротестостерон не подавляет выработку ЛГ-гормона, а тестостерон подавляет. По сравнению с тестостероном, 5-дигидротестостерон имеет менее выраженные анаболические свойства. По-видимому, 4-5 ()-двойная связь в молекуле тестостерона, ослабляя андрогенные свойства, усиливает в природных андрогенах анаболическое действие. Вероятно, это обусловлено тем, что в клетках мужского полового аппарата преобладают андрогенные рецепторы, имеющие наибольшее сродство к 5-дигидротестостерону, в то время как в мышцах и некоторых других тканях доминируют циторецепторы с наибольшим сродством к тестостерону.
В экспериментах над животными было обнаружено, что производные андростана могут выполнять функции половых феромонов у самцов.
Биосинтез андрогенов
Андрогены продуцируются клетками семенников, яичников, коры надпочечников. Семенники - мужские гонады (половые железы), расположенные у половозрелых мужчин вне брюшной полости, в мошонке, и имеющие дольчатое строение. В дольках находятся семенные канальцы, в которых осуществляется сперматогенез. Гормонпродуцирующими клетками семенников являются интерстициальные клетки Лейдига, расположенные между семенными канальцами. В них образуется главный мужской половой гормон (андроген) - тестостерон, регулирующий репродуктивные функции в организме самца, а также неактивные соединения андрогенного ряда - андростендион, дегидроэпиандростерон и небольшое количество женских половых гормонов - эстрогенов и прогестинов. В других гормонпродуцирующих клетках - клетках Сертоли - синтезируются ингибин (фолликулостатин), ингибирующий сперматогенез, а у эмбрионов - фактор регрессии мюллеровых каналов (ФРМК). Яичники - женские гонады, расположенные внутри брюшной полости на уровне входа в малый таз. Внутрисекреторная часть яичника представлена фолликулами, жёлтыми телами, а также интерстициальной тканью. В стромальных клетках яичников синтезируются гормоны - тестостерон и ФРМК, тормозящий у эмбрионов фолликулогенез. Надпочечники - парный орган, расположенный вблизи верхнего полюса почки, включает две самостоятельные эндокринные железы - кору и мозговой слой. Кора надпочечников (адреналовая кора, интерреналовая ткань) - наружный слой надпочечника, состоящий из трёх зон: поверхностной - клубочковой, средней - пучковой и внутренней - сетчатой. В сетчатой зоне коры надпочечников образуются некоторые соединений андрогенного ряда - андростендион, 11-оксиандростендион, адреностерон, дегидроэпиандростерон и его сульфат. Эти соединения сами по себе биологически неактивны, но способны превращаться на периферии в активные формы мужских половых гормонов (андрогены).
Биосинтез
гормонов - цепи биохимических реакций,
приводящих к формированию специфической
структуры гормональной молекулы. Реакции
синтеза гормона в дифференцированной
железе протекают спонтанно и закреплены
генетически в соответствующих эндокринных
клетках. Синтез стероидных гормонов
осуществляется под ферментативным
контролем в клетках стероидогенных
желёз главным образом мезодермального
происхождения. Как было перечислено
выше, к ним относятся клетки Лейдинга
семенников, стромальные клетки яичников
и кора надпочечников. Биосинтез стероидных
гормонов происходит из общего для них
предшественника холестерина -
С27-5-стероида,
который поступает в стероидогенные
клетки из крови в составе липопротеидов
разной плотности или синтезируется в
них из ацетата. Доставка холестерина к
внутренней мембране митохондрии
стероидогенным белком быстрой регуляции
является фактором, ограничивающим
скорость синтеза тестостерона. Этот
белок и ферменты, участвующие в образовании
тестостерона, стимулируются ЛГ.
Превращение холестерина в тестостерон
включает пять стадий, каждая из которых
осуществляется ферментом. Первой
реакцией в этом процессе является
отщепление боковой цепи холестерина в
митохондриях с образованием прегненолона;
остальные четыре фермента в пути синтеза
локализованы микросомах.

Схематически биосинтез главных стероидных гормонов, в том числе андрогенов, можно представить в виде трёх общих и начальных этапов:
1) освобождение холестерина из липидных капель и его переход в митохондрии, где неэстерифицированный холестерин образует комплексы с белками внутренней митохондриальной мембраны;
2) укорочение боковой цепи холестерина на 6 углеродных атомов (C27 - C21) с образованием прегненолона - ключевого предшественника гормонов, покидающего митохондрии;
3) переброска двойной связи из кольца B в кольцо A и отщепление водорода у C3 с образованием -кетостероидов типа прогестерона, осуществляемых в микросомах клетки.
Все указанные этапы контролируются в основном соответствующими тропными гормонами гипофиза, а именно АКТГ и ЛГ.
Пути биосинтеза андрогенов в разных тканях были подробно исследованы в лабораториях Сэмьюэльса (1956 - 1963) и Дорфмана (1956 - 1965). Характерная черта большинства линий биогенеза андрогенов - отщепление боковой цепи от C21-стероидов (производных прогестерона и прегненолона) с образованием C19-соединений:
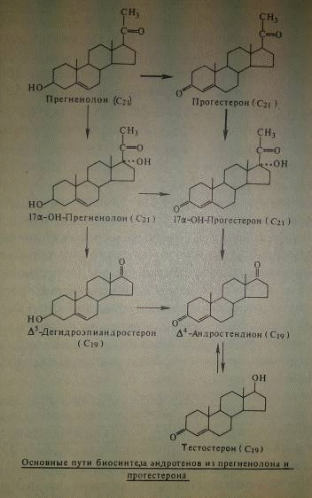
При наличии 17-гидроксила в молекуле C21-стероидов под влиянием специального фермента десмолазы происходит окислительное отщепление 20-го и 21-го углеродных атомов, приводящее к образованию андрогенной молекулы. Однако образование C19-стероидов может происходить и одноступенчато из холестерина, минуя стадию C21-стероидов.
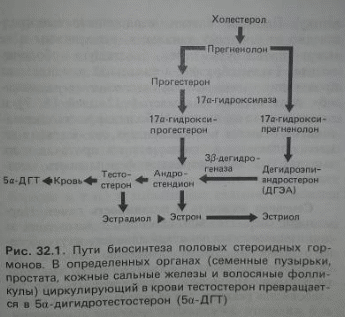
В гонадах тестостерон может образовываться из 17-оксипрогестерона через прогестерон-ацетат, минуя стадию андростендиона. Синтез андрогенов в семенниках и яичниках, но не в надпочечниках, регулируется ЛГ, который обладает способностью значительно увеличивать биосинтез и секрецию суммарных андрогенов, но не влияющий на их соотношение. В отличие от гонад, в коре надпочечников, по-видимому, преобладают пути 5-пути синтеза андрогенов. Главный секреторный продукт семенника - тестостерон, однако некоторые предшественники пути синтеза, а также небольшие количества дигидротестостерона и эстрадиола также прямо секретируются семенником. Главные места образования дигидротестостерона и эстрадиола - ткани-мишени для андрогенов и жировая ткань соответственно. Концентрации тестостерона в семенниковой лимфе и семенниковой венозной крови сходны, однако из-за большей скорости кровотока главный путь секреции тестостерона лежит через семенную вену. В нормальных семенниках находится приблизительно 25 мкг тестостерона, так что общее содержание гормона должно оборачиваться несколько сот раз каждый день для обеспечения ежедневной секреции 5-10 мг тестостерона. Секретируемые надпочечниками и гонадами андростендион и неконъюгированный дегидроэпиандростерон также могут превращаться на периферии в тестостерон.
Андрогены надпочечников представляют собой третий класс стероидов надпочечников. Несмотря на их название, ни дигидроэпиандростерон, ни сульфатированное призводное дигидроэпиандротерон-сульфат не активируют андрогенный рецептор. Однако в периферических тканях они являются предшественниками, которые могут превращаться в сильный андроген - тестостерон. Интересно, что секреция громадного количества предшественников андрогенов сетчатой зоной ограничивается приматами, у которых уровни ДГЭА и ДГЭА-С в циркуляции имеют зависимые от возраста и пола профили, отличные от таковых любого другого стероидного гормона. Надпочечники плода продуцируют in utero громадные количества ДГЭА-С, который превращается в эстрогены в плаценте. После рождения продукция ДГЭА-С резко снижается и остаётся на низком уровне в младенчестве и раннем детстве. Возобновление продукции ДГЭА-С сетчатой зоной надпочечников в 7-8 лет называют адренархе. Такое возобновление ведёт к превращению андрогенов надпочечников в активные андрогены в тканях-мишенях, что инициирует рост лобковых и подмышечных волос перед наступление стероидогенеза в гонадах. Продукция продолжает расти в течение второго десятилетия жизни, но затем прогрессивно снижается с возрастом. Хотя ДГЭА и ДГЭА-С вовлечены в огромное количество физиологических и патофизиологических процессов, андрогены надпочечников не существенны для жизни, и их обычно не вводят при заместительной терапии первичной надпочечниковой недостаточности. Следует отметить, однако, что ДГЭА доступен в США как пищевая добавка, которую можно применять без совета или наблюдения врача.
Точная физиологическая роль андрогенов надпочечников и механизмы, регулирующие их продукцию, остаются плохо выясненными. Наиболее важен среди андрогенов надпочечников ДГЭА. У женщин этот андроген выделяется надпочечниками в физиологических условиях, однако при некоторых патологических состояниях его в значительных количествах секретируют яичники. У мужчин 2/3 всего количества андрогенов секретируют семенники и только 1/3 - надпочечники. Высокая концентрация АКТГ также стимулирует синтез и секрецию андрогенов. Известно, что АКТГ может индуцировать продукцию андрогенов надпочечников, но характерные изменения уровней ДГЭА и ДГЭА-С в течение жизни не параллельны изменениям АКТГ; таким образом, другие внешние или внутренние факторы также должны модулировать синтез андрогенов надпочечников. Это действие АКТГ играет центральную роль в развитии адреногенитального синдрома (врождённой гиперплазии надпочечников). При этом заболевании образование кортизола частично или полностью блокировано из-за ферментной недостаточности. На гипоталамо-гипофизарно-надпочечниковую систему данный дефект оказывает такое же влияние, как адреналэктомия, т.е. при нём отсутствует отрицательная обратная связь, осуществляемая в нормальных условиях кортизолом. Гипоталамус секретирует поэтому больше КРГ, что приводит к повышенной секреции АКТГ гипофизом. В связи с ферментной недостаточностью надпочечник не может вырабатывать достаточное количество кортизола, но секретирует в избытке другие стероиды, в том числе андрогены. Избыток андрогенов может вызвать вирилизацию плода, имеющего женский генотип, и развитие у него мужского фенотипа.
Адреногенитальный синдром может быть выражен в разной степени, и в некоторых случаях имеет место не только вирилизация, но и потеря солей, связанная с низкой секрецией альдостерона. Иногда ферментная недостаточность сказывается в более позднем возрасте, и симптомы заболевания проявляются только в период полового созревания или вскоре после его завершения (поздний адреногенитальный синдром). Андрогены надпочечников наиболее важны клинически при наследственной гиперплазии надпочечников, врождённых дефектах стероидогенеза надпочечников, при которых большие количества предшественников направляются по пути синтеза андрогенов. Наличие и степень избытка или недостаточности андрогенов зависит от дефекта конкретного фермента.
