Открытие ионов бария
4.1. Реакция с серной кислотой - фармакопейная реакция. Серная кислота и растворимые сульфаты с ионами бария Ва2+ образуют белый кристаллический осадок, нерастворимый в минеральных кислотах:
Ba2+ + SO42- BaSO4
Выполнение реакции: поместите в пробирку 1-2 капли раствора соли бария и добавьте к нему 2-3 капли 1 М раствора H2SO4.
Запишите наблюдения и уравнение реакции в молекулярном и ионно-молекулярном виде.
4.2. Реакция с хроматом калия, K2CrO4 или дихроматом калия, K2Cr2O7. Хромат калия с ионами бария Ва2+ при рН = 4-5 образует желтый осадок хромата бария ВаCrO4:
Ba2+ + CrO42- ВаCrO4
Хромат бария растворим в сильный кислотах (кроме H2SO4), но нерастворим в уксусной кислоте. При проведении реакции в уксуснокислой среде определению иона бария не мешают ионы Ca2+, так как осадок CaCrO4 не образуется.
Предел обнаружения бария — 0,15 мг. Ионы Hg(I, II), Ag+, Pb2+, Bi3+ и Fe3+ мешают обнаружению бария, так как образуют окрашенные хроматы. Ионы Са2+ и Sr2+ при рН<7 не образуют осадков с К2Сr2О7 и не мешают обнаружению бария. Эта реакция используется для отделения Ва от Sr и Са. Предел обнаружения бария — 0,08 мкг.
Выполнение реакции: смешайте в пробирке по 5 капель растворов хлорида бария и хромата калия. Полученный осадок разделите на две пробирки. В первую пробирку с осадком добавьте 2-3 мл 2 М раствора HCl, а в другую - 2-3 мл 2 М раствора СН3СООН.
Запишите наблюдения и уравнение реакции в молекулярном и ионно-молекулярном виде.
4.3. Окрашивание пламени - фармакопейная реакция. Соли бария окрашивают пламя газовой горелки в желто-зеленый цвет.
Выполнение реакции: чистую нихромовую проволоку опустите в насыщенный раствор соли бария или в сухую соль и затем внесите её в пламя газовой горелки. Запишите наблюдения в тетрадь.
Открытие ионов кальция
Определение кальция по ГФXI осуществляют 2 методами.
5.1. Реакция с оксалатом аммония, (NH4)2C2O4. Весьма специфической реакцией на ион кальция является реакция образо- вания белого осадка оксалата кальция:
Ca2+ + (NH4)2C2O4 → CaC2O4↓ + 2NH4+
Осадок оксалата кальция нерастворим в уксусной кислоте и растворе аммиака, но растворим в минеральных кислотах. Этой качественной реакции на ион кальция мешают лишь ионы бария и стронция. С помощью этой реакции можно открыть кальций в препаратах, растворимых в воде, таких, как кальция хлорид, кальция глюконат, кальция добезилат, кальция лактат и др. В препаратах, очень малорастворимых или практически нерастворимых в воде (бепаск, гипс жженый), открыть кальций непосредственно с помощью этой реакции нельзя. Это можно сделать только после предварительной обработки препарата и перевода кальция в раствор.
Осадок растворим в сильных кислотах, но нерастворим в уксусной кислоте:
2ВаC2O4 + 2СН3COOН = Ва(НC2O4)2 + Ва(СН3COO)2
Предел обнаружения кальция — 20 мкг. Мешают ионы Ва2+ и Sr2+, дающие с (NH4)2C2O4 аналогичные осадки. Отличительной особенностью осадков ВаС2О4 и SrC2O4 является их растворимость в уксусной кислоте:
Выполнение реакции: поместите в пробирку 1-2 капли раствора соли кальция, 3-4 капли раствора (NH4)2C2O4 и 1-2 капли 2 М раствора аммиака. Полученный осадок разделите на две части. В первую пробирку с осадком добавьте 2-3 мл 2 М раствора HCl, а в другую - 2-3 мл 2 М раствора СН3СООН.
Запишите наблюдения и уравнение реакции в молекулярном и ионно-молекулярном виде.
5.2. Окрашивание пламени - фармакопейная реакция. Второй метод открытия кальция основан на реакции окрашивания пламени. С помощью реакции окрашивания пламени можно открыть кальций во всех соединениях, как растворимых в воде, так и нерастворимых. Обязательным условием проведения этой пробы является смачивание препарата раствором хлористоводородной кислоты. Смысл этой операции заключается в том, чтобы перевести ту или иную соль кальция в хлорид кальция, который летуч и поэтому окрашивает бесцветное пламя в характерный кирпично-красный цвет.
Выполнение реакции: чистую нихромовую проволоку опустите в насыщенный раствор хлорида кальция или в сухую соль и затем внесите её в пламя газовой горелки. Запишите наблюдения в тетрадь.
5.3. Реакция с серной кислотой (предложена в ГФX). Серная кислота и растворимые сульфаты в концентрированных растворах образуют с катионом кальция Са2+ кристаллы гипса CaSO42Н2О белого цвета, имеющие игольчатую форму:
Сa2+ + SO42- + 2 Н2О СaSO4 • 2Н2О
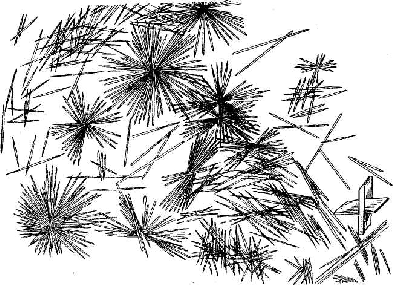
Эта микрокристаллоскопическая реакция основана на образовании характерных игольчатых кристаллов сульфата кальция CaSO4•2H2O (рис. 1, 2).
|
|
Рисунок 1. Кристаллы CaS04•2H2O,образующиеся в концентрированных растворах |
Рис. 2. Кристаллы СаSО4•2Н2О, образующиеся в разбавленныхрастворах
|
Предел обнаружения кальция – 1 мкг. Мешают ионы Рb2+, Ва2+ и Sr2+, если они присутствуют в 10-кратном избытке по отношению к кальцию.
Выполнение реакции: поместите на предметное стекло 1 каплю раствора соли кальция, прибавьте к нему 1 каплю 1 М раствора H2SO4 и 1 каплю С2Н5ОН для уменьшения растворимости. Осторожно нагрейте предметное стекло на водяной бане до появления белых кристаллов гипса.
Запишите наблюдения и уравнение реакции в молекулярном и ионно-молекулярном виде.
5.4. Гексацианоферрат (II) калия при рН>7 в присутствии NH4Cl взаимодействует с ионами кальция с образованием белого кристаллического осадка состава Kn(NH4)mCaFe(CN)6 , где n и m в зависимости от условий могут меняться от 0 до 2:
СаСl2 + K4Fe(CN)6 + NH4Cl = KNH4CaFe(CN)6 + 3КСl.
Предел обнаружения кальция — 50 мкг. Осадок нерастворим в уксусной кислоте. Это позволяет отличить его от SrCO3, который может образоваться в присутствии ионов CO32–, содержащихся в щелочных растворах. Ионы Ва2+ и Mg2+ мешают реакции обнаружения кальция.
Выполнение реакции. На часовом стекле перемешивают каплю исследуемого раствора с 2—3 каплями раствора реагента, затем добавляют 1–2 капли раствора NH4Cl, каплю этанола и снова перемешивают. Помутнение или появление кристаллического осадка указывает на присутствие кальция. Удобнее пользоваться черной капельной пластинкой или часовое стекло помещать на черную бумагу.