
ЭЛЕМЕНТЫ КАЧЕСТВЕННОГО АНАЛИЗА
Вопросы
Фармакопейные реакции катионов s-элементов.
Фармакопейные реакции катионов р-элементов и анионов, содержащих р-элементы.
Фармакопейные реакции катионов d-элементов и анионов, содержащих d-элементы.
Для определения качественного химического состава вещества пользуются как химическими, так и физико-химическими методами анализа.
Химические методы основаны на использовании химических реакций определяемого элемента с различными реагентами. В качественном анализе используются аналитические реакции. Аналитическая реакция - это реакция, которая сопровождается каким-либо внешним эффектом (образованием или растворением осадка, выделением газа, изменением окраски раствора и т.д.), позволяющим сделать вывод о наличии соответствующих ионов или молекул в анализируемом веществе. Аналитические реакции делятся на специфические и групповые.
Специфическая реакция – это аналитическая реакция, внешний эффект которой характерен только для данного иона или соединения. С помощью специфической реакции ион может быть обнаружен в присутствии других ионов.
Групповая реакция – это реакция, внешний эффект которой характерен для группы ионов. С помощью групповых реакций смеси ионов разделяют на аналитические группы.
Большинство аналитических реакций выполняется в водных растворах. Так как подавляющее большинство неорганических соединений в растворах диссоциировано, то при анализе практически определяются не элементы вообще, а ионы. Поэтому качественный анализ делится на анализ (открытие, обнаружение) катионов и анализ анионов.
Дробный и систематический методы анализа
Качественный анализ может быть выполнен дробным или систематическим методом.
Дробный метод анализа заключается в том, что ионы открывают в любой последовательности при помощи специфических реакций в отдельных пробах раствора в присутствии других ионов. Однако не всегда дробный метод можно использовать на практике, так как не для всех ионов имеются специфические реакции. Поэтому при анализе смеси ионов в основном пользуются систематическим методом анализа.
Систематический метод качественного анализа заключается в том, что смесь ионов с помощью групповых реагентов предварительно разделяют в определенной последовательности на аналитические группы. Отдельные ионы внутри каждой группы обнаруживаются с помощью их аналитических реакций после разделения или в условиях, устраняющих (маскирующих) влияние других ионов.
Систематический анализ начинают с осаждения и отделения хлоридов катионов II аналитической группы. Затем переводят в осадок и отделяют сульфаты катионов III аналитической группы. При обработке раствора, полученного после осаждения катионов II и III аналитических групп, избытком раствора гидроксида натрия в осадок переводят основные по своей природе гидроксиды катионов V и VI групп, а в растворе остаются катионы IV аналитической группы в виде соответствующих гидроксокомплексов.
При обработке концентрированным раствором аммиака осадка, содержащего катионы V и VI аналитических групп, катионы VI аналитической группы образуют растворимые комплексные соединения - аммиакаты, тогда как катионы V аналитической группы остаются в осадке в виде соответствующих гидроксидов.
После разделения катионов на группы с помощью групповых реагентов проводят обнаружение ионов внутри каждой группы.
АНАЛИТИЧЕСКИЕ (ФАРМАКОПЕЙНЫЕ) РЕАКЦИИ КАТИОНОВ s-ЭЛЕМЕНТОВ
Открытие ионов лития
1.1. Торон [1(2-арсонофенилазо)-2-нафтол-3,6-дисульфокислота] с ионами лития в щелочном растворе образует растворимое в воде комплексное соединение с соотношением компонентов L i:R = l : l
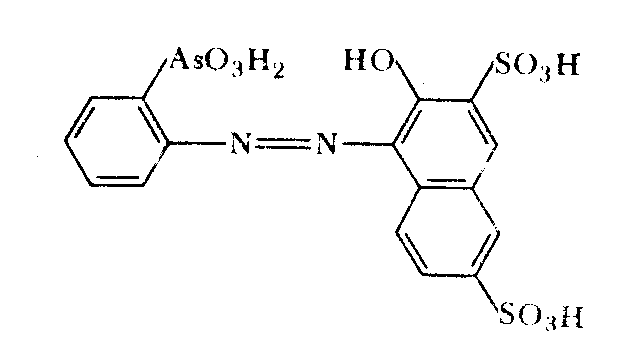
В щелочной среде торон имеет оранжево-красную окраску, комплекс лития с тороном желтую. Природа связи в комплексе неизвестна. Соединение не экстрагируется хлороформом, бутанолом, амилацетатом. Реакцию можно проводить в водно-ацетоновой среде (70% ацетона). Предел обнаружения лития – 2 мкг. Анализу мешают ионы Са2+, Sr2+, Ba2+, Mg2+, Ni2+, Co2+. Мешающее действие катионов устраняют, маскируя их ЭДТА.
Выполнение реакции. В пробирку помещают 2 капли раствора торона, 2 капли 30%-ного раствора NaOH и 1 каплю анализируемого раствора. В присутствии ионов лития раствор окрашивается в желтый цвет, в отсутствие ионов лития остается красно-оранжевым (холостой опыт).
В присутствии мешающих катионов реакцию проводят следующим образом: к 4—5 каплям раствора добавляют 1—2 капли насыщенного раствора ЭДТА, 2 капли 30%-ного раствора NaOH и 1—2 капли раствора торона.
1.2. Люминесцентная реакция. 8-оксихинолин с ионами лития в щелочной среде образует соединение, обладающее голубовато-зеленой флуоресценцией. Предел обнаружения лития – 0,2 мкг. Не мешают 100 кратные количества ионов Na+, К+. При рН 9–10 флуоресцирующие оксихинолинаты дают ионы Al3+, Mg2+, Zn2+, поэтому их необходимо предварительно отделить.
Выполнение реакции. На фильтровальную бумагу наносят каплю раствора, содержащего ионы лития, каплю 2 М раствора КОН или NaOH и каплю 0,03%-ного этанольного раствора реагента. Образовавшееся пятно высушивают на воздухе и наблюдают голубовато-зеленое свечение в ультрафиолетовом свете.
Окрашивание пламени. Летучие соли лития (LiCl, LiNO3) окрашивают пламя газовой горелки в карминово-красный цвет. В спектроскопе прямого зрения наблюдают линию при 670 нм.
Открытие ионов калия
На препараты, содержащие калий, в ГФXI приводятся 3 методики.
2.1. Реакция с винной кислотой – фармакопейная реакция. В основе метода лежит реакция образования малорастворимого в воде гидротартрата калия:
K+ + H2C4H4O6 + CH3COONa → KHC4H4O6↓ + CH3COOH + Na+
Для успешного выполнения этой реакции необходимо точно выдерживать условия. Это обусловлено тем, что из всех 5 калиевых и натриевых солей винной кислоты лишь гидротартрат калия малорастворим в воде, поэтому важным является не только поддержание необходимого значения рН раствора, но и указанного соотношения реактивов. Добавление небольшого количества спирта способствует кристаллизации гидротартрата калия. Целесообразно также потирать стенки пробирки стеклянной палочкой и охлаждать реакционную смесь.
Важные условия проведения рассматриваемой реакции таковы:
1. достаточно большая концентрация ионов калия в растворе;
2. слабокислая или нейтральная реакция раствора (рН 4-7);
3. проведение реакции на холоду (это особенно важно иметь в виду в летний период, поскольку в ГФXI не оговорены температурные условия метода).
В ы п о л н е и е ре а к ц и и. К 2—3 каплям раствора, содержащего ионы калия, прибавляют 2—3 капли раствора гидротартрата натрия и для ускорения образования осадка потирают ст еклянной палочкой по стенкам пробирки. Выпадает белый кристаллический осадок.
При использовании в качестве реагента винной кислоты необходимо добавить 2—3 капли раствора ацетата натрия.
2.2. Реакция с гексанитрокобальтатом (III) натрия, Na3[Co(NO2)6] – фармакопейная реакция. В основе второго метода лежит реакция с кобальтинитритом натрия, в ходе которой образуется желтый кристаллический осадок:
2K+ + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2Na+
Этот осадок нерастворим в уксусной кислоте, так как она слабее азотистойкислоты, входящей в состав комплексного иона [Co(NO2)6]3–. рН раствора должно находиться в пределах 4-5. Следует иметь в виду, что щелочная реакция раствора совершенно недопустима, так как при действии щелочей реагент разлагается и выпадает темно-бурый осадок гидроксида кобальта (III):
[Co(NO2)6]3– + 3OHˉ → Co(OH)3↓ + 6NO2ˉ
При действии минеральных кислот осадок K2Na[Co(NO2)6] растворяется с разложением и выделением токсичных окислов азота, поэтому ГФXI не предусматривает исследование растворимости осадка ни в кислотах, ни в щелочах. При утилизации продуктов этой реакции следует соблюдать осторожность и не допускать действия хлористоводородной кислоты, поскольку при этом наряду с окислами азота выделяется еще и хлор:
2K2Na[Co(NO2)6] + 12HCl→2CoCl2 + 4KCl + 2NaCl + 6H2O +6NO + 6NO2 +Cl2
Нужно также иметь в виду, что кобальтинитрит натрия в растворе сравнительно быстро разлагается, при этом бурая окраска переходит в розовую. Такой порозвевший раствор реагента для открытия иона калия непригоден.
Определению иона калия реакцией с кобальтинитритом натрия мешает ион аммония, который дает аналогичный желтый осадок, поэтому неорганические препараты, содержащие калий, предварительно прокаливают с целью удаления солей аммония. В том случае, если прокаливание невозможно (органические препараты, содержащие калий), для устранения мешающего влияния иона аммония к реакционной смеси добавляют раствор формальдегида.
Формальдегид реагирует с аммиаком, образуя гексаметилентетрамин, который не мешает определению иона калия.
Предел обнаружения калия – 20 мкг. Предел обнаружения можно существенно понизить (до 4 мкг) при выполнении реакции капельным методом.
В отсутствие галогенид-ионов для обнаружения калия можно использовать реакцию образования осадка K2AgCo(NO2)6. Замещение иона натрия ионом серебра приводит к понижению растворимости осадка, и предел обнаружения калия снижается до 2 мкг. Обнаружению мешают ионы аммония и лития, так как они образуют аналогичные желтые осадки. Мешают йодиды из-за окисления йодида нитритом до I2. Мешаютокислители, так как они разрушают реагент. Щелочноземельные элементы, Fe, Al, Zn и некоторые другие не дают осадков.
Выполнение реакции: поместите в пробирку 2-3 капли раствора соли калия и осторожно прибавьте 1-2 капли свежеприготовленного раствора Na3[Co(NO2)6] или несколько кристалликов сухой соли. Выполнению реакции мешают ионы NH4+, но осадок (NH4)2Na[Co(NO2)6] легко разлагается при нагревании. Поэтому реакцию следует проводить при нагревании. Если рН раствора >7, то следует добавить по каплям 2М раствор СH3COOH, если рН раствора <3, то следует добавить по каплям 2М раствор CH3COONa для достижения необходимого значения рН. Среда с рН>7 – недопустима.
Запишите наблюдения и уравнение реакции в молекулярном и ионно-молекулярном виде.
2.3. Окрашивание пламени - фармакопейная реакция. Третий метод открытия калия основан на окрашивании пламени. Окрашивание пламени используют прежде всего для анализа неорганических соединений калия. Органические препараты, содержащие калий, при сгорании которых пламя интенсивно окрашивается, нецелесообразно анализировать этим методом. Испытанию также сильно мешают соли натрия, окрашивающие пламя в интенсивный желтый цвет, который маскирует фиолетовую окраску пламени. В этом случае наблюдение цвета пламени осуществляют через синее стекло. Иногда рассматривают пламя через синее стекло или раствор индиго в специальной «индиговой призме» или склянке. В этих условиях можно обнаружить калий в присутствии натрия, так как синее стекло или раствор индиго поглощают желтые лучи натрия. Предел обнаружения калия – 0,0001 мкг.
Выполнение реакции: чистую нихромовую проволоку опустите в насыщенный раствор соли калия или в сухую соль калия и затем внесите её в пламя горелки. Окраску пламени лучше наблюдать через синее стекло. Запишите наблюдения в тетрадь.
Для очистки нихромовой проволоки опустите ее в концентрированный раствор HCl, затем внесите в пламя газовой горелки. Повторите эту операцию несколько раз. Отсутствие окрашивания пламени свидетельствует о чистоте нихромовой проволоки.
